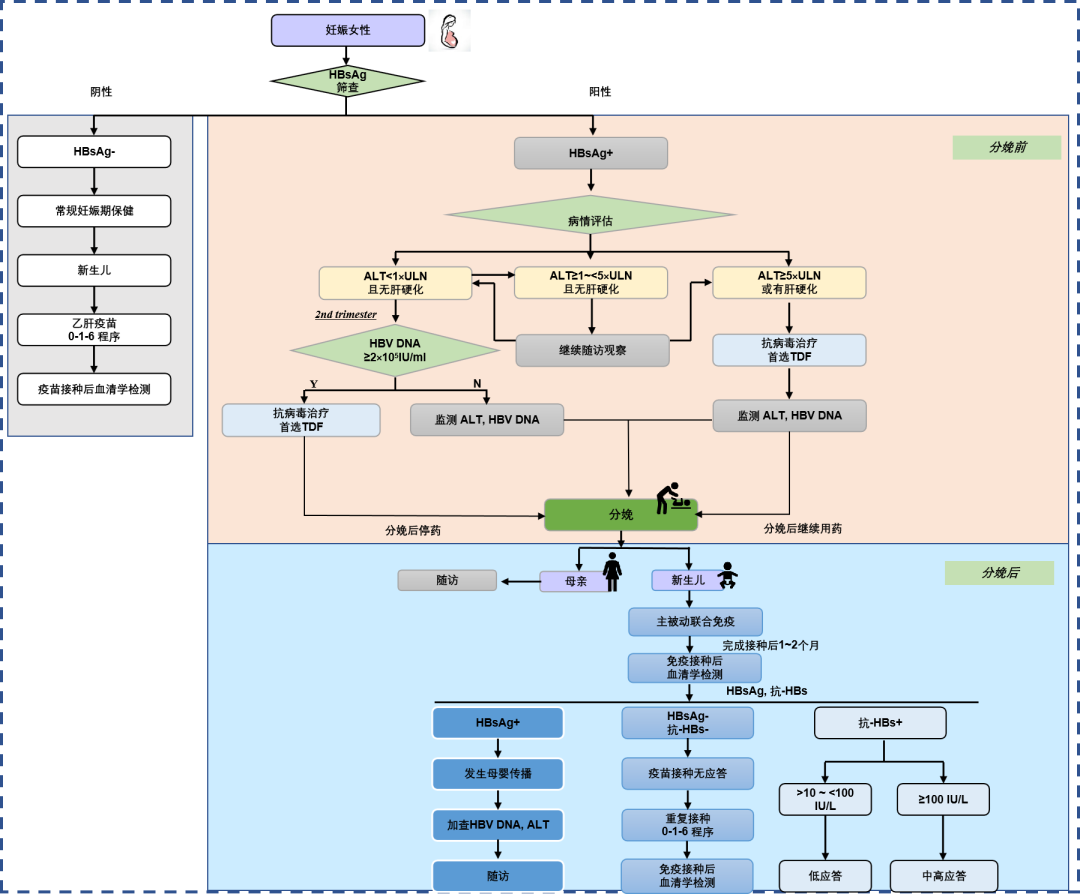
图1 阻断HBV母婴传播临床管理流程
1感染HBV孕妇的筛查
我国是乙肝的中高流行区,一般人群中乙肝表面抗原(HBsAg)阳性率约为6.1%[16],孕产妇中HBsAg阳性率约为6.3%[17]。在孕妇中普遍筛查HBV感染的血清标志物是实施HBV母婴阻断的第一个环节。我国预防艾滋病、梅毒和乙肝母婴传播项目要求所有孕早期孕妇,均应筛查艾滋病、梅毒和乙肝[18]。筛查HBV血清标志物应包括HBsAg和乙肝表面抗体(抗-HBs)。若HBsAg阴性,通常表明无HBV感染,给予提供常规孕期保健服务,并了解其丈夫有无HBV感染;若孕妇HBsAg阳性,表明存在HBV感染,需详细询问病史及家族史并按管理流程评估乙肝感染相关情况。由于乙肝存在家庭聚集性,建议其家庭成员筛查乙肝。
2HBV感染的病情评估及治疗
HBsAg阳性的孕妇需检测乙肝e抗原(HBeAg)、乙肝e抗体(抗-HBe)、HBV DNA水平、肝功能生化指标和上腹部超声,以判断其是否出现肝炎活动及纤维化分期,需特别关注是否存在肝硬化。
(1)若HBV DNA阳性,出现丙氨酸转移酶(ALT)显著异常,≥5×正常值上限(ULN),排除导致ALT升高的其他相关因素(如药物和脂肪肝等),或诊断为肝硬化者,经感染病或肝病专科医生评估及患者知情同意后,建议给予替诺福韦酯(TDF)抗病毒治疗。
(2)若HBV DNA阳性,1×ULN≤ALT<5×ULN,且总胆红素(TBil)<2×ULN时可继续观察,如果观察期间ALT≥5×ULN,或TBil≥2×ULN,则按2(1)处理;如果ALT<1×ULN,则按2(3)处理;如果随访至妊娠24周ALT仍为1×ULN≤ALT<5×ULN,经患者知情同意后,给予TDF 进行抗病毒治疗。
(3)若HBV DNA阳性,ALT正常、无肝硬化表现,可以暂不治疗,继续观察肝功能情况。在随访期间,如果出现ALT持续升高(ALT≥1×ULN),则根据ALT水平按2(1)或2(2)处理,注意TBil和凝血酶原活动度(PTA)的检查结果,用于判断肝损伤的严重程度。
(4)若HBV DNA低于检测下限,表明患者可能处于非活动期,建议于妊娠24周复查HBV DNA,若仍低于检测下限,则无需干预。
对于出现乙肝活动而需要进行抗病毒治疗的孕妇,治疗药物首选TDF,如果患者存在骨质疏松、肾损伤或肾损伤的危险因素,可选用富马酸丙酚替诺福韦(TAF)治疗。
3阻断HBV母婴传播的抗病毒治疗
对高HBV载量的孕妇在妊娠晚期进行抗病毒,结合新生儿乙肝疫苗和乙肝免疫球蛋白(HBIG)的接种,能够进一步降低HBV母婴传播发生率,并且未增加胎儿的不良妊娠结局[9-11]。因此,妊娠期抗病毒治疗阻断HBV母婴传播已被广泛接受并应用于临床实践中,对于消除HBV母婴传播起到了积极的作用[15]。
经病情评估后肝功能正常的未服用抗病毒药物的孕妇,在妊娠中期(12~24周)检测HBV DNA水平(推荐用高灵敏试剂检测),根据HBV DNA水平,决定是否需要进行抗病毒治疗阻断HBV母婴传播。如果无条件检测HBV DNA定量,可用HBeAg作为其替代指标,HBeAg阳性者给予抗病毒治疗[6]。
(1)若孕妇HBV DNA≥2×105 IU/ml,经知情同意后,可于妊娠28周给予TDF进行抗病毒治疗。如果孕妇存在骨质疏松、肾损伤或导致肾损伤的高危因素,或消化道症状严重,可以选择TAF或替比夫定(LdT)。分娩前应复查HBV DNA,以了解抗病毒治疗效果及HBV母婴传播的风险。
TAF在我国批准上市后,在母婴阻断的临床研究和临床实践中得到了初步的应用,现有的数据[13-14]表明,TAF用于妊娠期HBV母婴阻断的效果和安全性良好。TAF有望成为妊娠期抗病毒阻断HBV母婴传播的新选择。
(2)若孕妇HBV DNA<2×105 IU/ml,发生HBV母婴传播的风险低,一般对其新生儿乙肝疫苗+HBIG 免疫即可预防,不需要抗病毒干预。
(3)超过妊娠28周首次就诊的孕妇,若HBV DNA≥2×105 木IU/ml,仍建议尽早给予抗病毒干预。
4分娩及新生儿护理
(1)分娩方式:关于分娩方式与HBV母婴传播的关系,现有的研究结果不一致。虽然有研究[19-20]显示,剖宫产可以减少高病毒载量孕妇所生婴儿的HBV感染,然而荟萃分析[21]的结果表明,分娩方式与HBV母婴传播风险没有确切关系,剖宫产并未降低HBV母婴传播的发生率,故不建议根据HBV DNA水平或HBeAg状态选择分娩方式,应根据产科指征决定分娩方式。
(2)新生儿护理:新生儿出生后立即移至复苏台,离开母血污染的环境;彻底清除体表的血液、黏液和羊水;处理脐带前,需再次清理、擦净脐带表面血液等污染物,按操作规程安全断脐。
5停药时机
妊娠期服用抗病毒药物的母亲的停药时机取决于妊娠期抗病毒治疗的目的:(1)以阻断HBV母婴传播为目的而服用抗病毒药物的孕妇,分娩后检测HBsAg和HBeAg定量,如果HBsAg和/或HBeAg水平显著下降,提示抗病毒治疗效果良好,可继续抗病毒治疗。如果HBsAg和/或HBeAg水平下降不明显,产后立即停药。(2)以治疗乙肝为目的而服用抗病毒药物的孕妇,产后不能停药,应长期抗病毒治疗。
6婴儿免疫
新生儿免疫接种是阻断HBV母婴传播的最重要的措施,对母亲HBsAg阳性孕妇的新生儿,首剂乙肝疫苗和HBIG的接种时机非常关键。新生儿出生后12小时内应尽快完成乙肝疫苗和HBIG的联合免疫[2,22];HBsAg阴性母亲的新生儿应于产后12小时内尽快完成首剂乙肝疫苗接种。
(1)常规疫苗接种:在新生儿大腿前部外侧肌肉或上臂三角肌内接种重组酵母乙肝疫苗10 μg/0.5 ml,同时在对侧相应部位注射HBIG 100 IU,在其1月龄和6月龄时分别接种相同剂量的第2和第3针乙肝疫苗。
(2)正常产新生儿的免疫接种:
① HBsAg阳性母亲的新生儿:于出生12小时内接种重组酵母乙肝疫苗10 μg/0.5 ml + HBIG 100 IU,并于1和6月龄各注射1针重组酵母乙肝疫苗10 μg/0.5 ml;
② HBsAg不详母亲的新生儿:则按母亲HBsAg阳性处理,即于出生12小时内接种重组酵母乙肝疫苗10 μg/0.5 ml + HBIG 100 IU,同时尽快检测母亲HBsAg,明确母亲是否为HBsAg阳性后,按规范及时为婴儿接种乙肝疫苗;
③ HBsAg阴性母亲的新生儿:于出生12小时内接种重组酵母乙肝疫苗10 μg/0.5 ml,并于1和6月龄各注射1针重组酵母乙肝疫苗10 μg/0.5 ml。
(3)低体质量儿(<2000 μg)或早产儿(<妊娠37周)的免疫接种:
① HBsAg阳性母亲的低体质量儿或早产儿:于出生12小时内尽快完成联合免疫,即接种重组酵母乙肝疫苗10 μg/0.5 ml+HBIG 100 IU,并于1、2和7月龄各注射1针重组酵母乙肝疫苗10 μg/0.5 ml;
② HBsAg不详母亲的低体质量儿或早产儿:于出生12小时内尽快完成联合免疫,即接种重组酵母乙肝疫苗10 μg/0.5 ml+HBIG 100 IU,同时尽快检测母亲HBsAg,明确母亲是否为HBsAg阳性后,按规范及时为婴儿接种乙肝疫苗;
③ HBsAg阴性母亲的低体质量儿或早产儿:最好于出生12小时内接种首针重组酵母乙肝疫苗10 μg/0.5 ml,并于1、2和7月龄各注射1针重组酵母乙肝疫苗10 μg/0.5 ml;也可在出院时或1月龄时接种重组酵母乙肝疫苗10 μg/0.5 ml,并在2和7月龄各接种1针乙肝疫苗10 μg/0.5 ml。
(4)危重症新生儿的免疫接种:如极低出生体质量儿(出生体质量<1500 g)、严重出生缺陷、重度窒息、呼吸窘迫综合征等,应在生命体征平稳后尽早接种[参照低体质量儿(<2000 g)或早产儿(<妊娠37周)的免疫接种]。
(5)疫苗延迟接种的处理:为保证婴儿乙肝免疫接种的效果,建议严格按0-1-6免疫程序接种,特别是HBsAg阳性母亲的新生儿,尽量不延期接种。如婴儿有特殊情况,不能如期接种第2针乙肝疫苗,可延迟接种,但最长不能超过3个月,第3针疫苗仍可在6月龄时注射。
7母乳喂养
母乳喂养并未增加婴儿的HBV感染率[23-24],感染HBV母亲分娩后可以哺乳。没有必要检测乳汁中的HBsAg和/或HBV DNA。
(1)母亲未服用抗病毒药物者,新生儿接受规范的联合免疫之后,可以进行母乳喂养[2-8],母乳喂养并未增加HBV母婴传播的发生率。如母乳喂养期间母亲出现乙肝活动,可参照《慢性乙型肝炎防治指南(2019更新版)》[4]中慢性乙肝患者的治疗原则给予抗病毒治疗,如果接受TDF治疗,可以母乳喂养。
(2)以阻断HBV母婴传播为目的而服用抗病毒药物的孕妇,分娩后停药,婴儿接受联合免疫之后,可以母乳喂养。
(3)以治疗乙肝为目的而服用抗病毒药物的孕妇,分娩后应继续用药,如果服用TDF治疗,TDF在乳汁中药物含量很少[25],母乳喂养并非禁忌。
8母亲产后随访
HBV感染母亲产后可能出现ALT升高。研究[26]表明,产后24周内,约有28%的HBV感染母亲出现肝功异常,孕妇HBV DNA高载量是产后肝功能异常的危险因素。
(1)产后继续服用抗病毒药物者,按慢性乙肝患者的随访方案进行随访,分娩后1年内每3个月复查肝功能、HBV DNA;每6个月复查乙肝血清标志物、甲胎蛋白、上腹部超声和肝脏瞬时弹性成像检查。
(2)产后停药者及未服用抗病毒药物者,产后6~8周复查肝功能生化学指标和HBV DNA。如果肝功能正常,分娩后每3个月复查肝功能、HBV DNA。如果肝功能异常且符合抗病毒治疗指征,应启动抗病毒治疗。
9婴儿免疫接种后的血清学检测
对HBsAg阳性母亲的婴儿,于完成乙肝全程免疫接种1~2个月后,需抽静脉血检测HBV血清学标志物,至少包括HBsAg和抗-HBs,建议采用定量检测方法。如HBsAg阳性,还需进一步检测HBV DNA水平和肝功能生化学指标,以后每6个月随访1次,复查肝功能生化学指标和病毒学指标。
10婴儿乙肝免疫接种效果评价
(1)免疫接种成功:婴儿完成乙肝全程免疫接种1个月后随访,如果HBsAg阴性,但抗-HBs阳性(抗-HBs≥10 mIU/ml),表明免疫接种成功,无需特殊处理。如果抗-HBs<100 mIU/ml,为低应答;如果抗-HBs≥100 mIU/ml,为中强应答。无论低应答还是中强应答,均无必要再次接种乙肝疫苗。
(2)免疫接种无应答:婴儿完成乙肝全程免疫接种后血清学检测结果显示,HBsAg阴性和抗-HBs<10 mIU/ml,无论抗-HBe及抗-HBc阳性与否,需按0-1-6程序重复免疫接种,仍使用重组酵母乙肝疫苗10 μg/0.5 ml。完成重复接种后1个月,再次检测HBsAg和抗-HBs,了解免疫应答和HBV感染情况。
(3)免疫接种失败,发生HBV母婴传播:婴儿完成乙肝疫苗全程免疫接种1个月后随访,HBsAg阳性,伴或不伴HBeAg阳性。发生HBV母婴传播的婴儿,还需检测HBV DNA和肝功能,并按慢性HBV感染者进行随访。如果出现肝炎活动,应及时进行抗病毒治疗,可以选择干扰素α、恩替卡韦或TDF治疗儿童乙肝患者。
待解决的问题:
(1)抗HBV新药- TAF是否可用于HBV母婴阻断:我国已于2018年批准TAF用于治疗慢性乙肝。作为TDF的改进版,TAF降低了肾损伤、骨密度降低等不良事件的发生率,目前已被美国肝病学会、欧洲肝病学会及中华医学会感染病学分会和肝病学分会制定的乙肝防治指南推荐为抗HBV的一线用药。
既然TAF比TDF安全,是否可以用于妊娠期阻断HBV母婴传播?国内外学者已对这一问题开展了临床研究,并且发表了初步的研究结果。根据已发表的研究[13-14]结果,TAF阻断HBV母婴传播的效果和安全性良好,有望成为阻断HBV母婴传播的新选择。未来还需要开展更严格的随机对照研究,为TAF阻断HBV母婴传播提供更高级别的循证医学证据。
(2)无HBIG的母婴阻断方案:感染HBV母亲的新生儿出生12小时内接种乙肝疫苗和HBIG是标准的阻断HBV母婴传播的方案,在国内外得到广泛的应用并取得了很好的阻断效果。然而,在欠发达的国家和地区,HBIG的可及性很低,在没有HBIG的情况下,妊娠期抗病毒干预结合婴儿乙肝疫苗接种的阻断效果如何,是一个有实际意义的新的科学问题。国内已开展多中心的临床试验对这一问题进行研究。
(3)妊娠期服用抗病毒药物的安全性:已发表的研究表明,妊娠期服用妊娠安全B类抗病毒药物对胎儿的生长发育无不良影响,未增加婴儿出生缺陷的发生率,且对婴儿出生后的骨代谢和生长发育无明显影响[11-12,27-28]。然而,由于阻断HBV母婴传播是在妊娠晚期(妊娠24~28周)启动抗病毒治疗,因此目前的安全性数据大多来源于妊娠晚期服用抗病毒药物的情况,而妊娠24周之前,特别是妊娠12周之前服药的安全性数据很少,尤其缺乏在妊娠不同阶段抗病毒治疗的安全性比较研究。
美国于1989年建立了抗逆转录病毒妊娠登记系统(APR),目的是为了发现与妊娠期抗逆转录病毒药物暴露相关的婴儿畸形。APR是一个国际性、自愿性和前瞻性的队列研究,现已有24 258名妊娠期暴露于抗病毒药物孕妇的登记数据[27]。我国孕产妇中HBV感染率约为6.3%[17],每年约有100万例感染HBV的孕产妇,妊娠期服用抗病毒药物的孕妇数量在不断增加。因此,有必要建立我国的妊娠期抗病毒治疗孕妇的登记系统,为基于大数据的抗病毒药物妊娠安全性研究提供基础。
(4)母亲产后停药随访:已发表的相关指南/共识均推荐为阻断HBV母婴传播而服用抗病毒药物的母亲产后即可停药,但在临床实践中发现有部分妊娠晚期开始抗病毒治疗的母亲,产后复查HBV DNA低于检测下限,且HBsAg和/或HBeAg水平显著下降,提示其HBV感染阶段可能已并非处于免疫耐受状态,因此继续治疗有望取得良好效果。当前尚缺乏对感染HBV母亲分娩停药后长期随访的研究。建立母亲产后停药随访队列,观察病毒学、血清学和生化学指标的变化,可以为优化产后管理提供依据。
编写专家成员名单
主审:庄辉(北京大学医学部基础医学院病原微生物学系)
主编:侯金林(南方医科大学南方医院感染内科)
编写专家(按姓氏拼音排序):
陈仲丹(世界卫生组织驻华代表处)、崔富强(北京大学公共卫生学院)、丁洋(中国医科大学盛京医院感染病科)、窦晓光(中国医科大学盛京医院感染病科)、高云飞(南方医科大学南方医院增城分院妇产科)、韩国荣(南京中医药大学附属南京医院,南京市第二医院妇产科)、侯金林(南方医科大学南方医院感染内科)、贾继东(首都医科大学附属北京友谊医院肝病中心)、李杰(北京大学医学部基础医学院病原微生物学系)、李增德(中国肝炎防治基金会)、刘映霞(深圳市第三人民医院感染科)、刘志华(南方医科大学南方医院感染内科)、毛青(陆军军医大学西南医院全军感染病研究所)、王爱玲(中国疾病预防控制中心妇幼保健中心)、王维(深圳市宝安区妇幼保健院预防保健科)、魏来(清华大学附属北京清华长庚医院肝胆胰病中心)、夏建红(广东省妇幼保健院保健部)、谢青(上海交通大学医学院附属瑞金医院感染科)、杨希忠(中国肝炎防治基金会)、尹雪如(南方医科大学南方医院感染内科)、张华(首都医科大学附属北京佑安医院妇产科)、张缭云(山西医科大学第一医院感染病科)、张文宏(复旦大学附属华山医院感染科)、庄辉(北京大学医学部基础医学院病原微生物学系)
参考文献:
[1]World Health Organization. Global health sector strategy on viral hepatitis 2016-2021[EB/OL]. (2016-06)[2021-02-01]. https://www.who.int/hepatitis/strategy2016-2021/ghss-hep/en/.
[2]Chinese Foundation for Hepatitis Prevention and Control; Chinese Society of Infectious Diseases, Chinese Medical Association; Chinese Society of Hepatology, Chinese Medical Association. Management algorithm for interrupting mother-to-child transmission of hepatitis B[J]. J Clin Hepatol, 2017, 33(7): 1214-1217. (in Chinese)
中国肝炎防治基金会, 中华医学会感染病学分会, 中华医学会肝病学分会. 乙型肝炎母婴阻断临床管理流程[J]. 临床肝胆病杂志, 2017, 33(7): 1214-1217.
[3]HOU J, CUI F, DING Y, et al. Management algorithm for interrupting mother-to-child transmission of hepatitis B virus[J]. Clin Gastroenterol Hepatol, 2019, 17(10): 1929-1936.e1.
[4]Chinese Society of Infectious Diseases, Chinese Medical Association; Chinese Society of Hepatology, Chinese Medical Association. Guidelines for the prevention and treatment of chronic hepatitis B (version 2019)[J]. J Clin Hepatol, 2019, 35(12): 2648-2669. (in Chinese)
中华医学会感染病学分会, 中华医学会肝病学分会. 慢性乙型肝炎防治指南(2019年版)[J]. 临床肝胆病杂志, 2019, 35(12): 2648-2669.
[5]Obstetrics Subgroup, Chinese Society of Obstetrics and Gynecology, Chinese Medical Association; Chinese Society of Perinatal Medicine, Chinese Medical Association. 2020 clinical guidelines on prevention of mother-to-child transmission of hepatitis B virus[J]. J Clin Hepatol, 2020, 36(7): 1474-1481. (in Chinese)
中华医学会妇产科学分会产科学组, 中华医学会围产医学分会. 乙型肝炎病毒母婴传播预防临床指南(2020)[J]. 临床肝胆病杂志, 2020, 36(7): 1474-1481.
[6]World Health Organization. Prevention of mother-to-child transmission of hepatitis B virus: guidelines on antiviral prophylaxis in pregnancy[EB/OL]. (2020-07-27)[2021-02-01].https://www.who.int/publications/i/item/978-92-4-000270-8.
[7]Chinese Society of Hepatology, Chinese Medical Association. Consensus on the management of hepatitis B virus infection in women of childbearing age[J]. J Clin Hepatol, 2018, 34(6): 1176-1180. (in Chinese)
中华医学会肝病学分会. 感染乙型肝炎病毒的育龄女性临床管理共识[J]. 临床肝胆病杂志, 2018, 34(6): 1176-1180.
[8]Chinese Society of Hepatology, Chinese Medical Association, China Grade Center. 2019 Chinese practice guideline for prevention and treatment of hepatitis B virus mother-to-child transmission[J]. Chin J Infect Dis, 2019, 37(7): 388-396.
中华医学会感染病学分会, 中国Grade中心. 中国乙型肝炎病毒母婴传播防治指南[J]. 中华传染病学杂志, 2019, 37(7): 388-396.
[9]ZHANG H, PAN CQ, PANG Q, et al. Telbivudine or lamivudine use in late pregnancy safely reduces perinatal transmission of hepatitis B virus in real-life practice[J]. Hepatology, 2014, 60(2): 468-476.
[10]CHEN HL, LEE CN, CHANG CH, et al. Efficacy of maternal tenofovir disoproxil fumarate in interrupting mother-to-infant transmission of hepatitis B virus[J]. Hepatology, 2015, 62(2): 375-386.
[11]PAN CQ, DUAN Z, DAI E, et al. Tenofovir to prevent hepatitis B transmission in mothers with high viral load[J]. N Engl J Med, 2016, 374(24): 2324-2334.
[12]JOURDAIN G, NGO-GIANG-HUONG N, HARRISON L, et al. Tenofovir versus placebo to prevent perinatal transmission of hepatitis B[J]. N Engl J Med, 2018, 378(10): 911-923.
[13]ZENG QL, YU ZJ, JI F, et al. Tenofovir alafenamide to prevent perinatal hepatitis B transmission: A multicenter, prospective, observational study[J]. Clin Infect Dis, 2021. [Online ahead of print]
[14]DING Y, CAO L, ZHU L, et al. Efficacy and safety of tenofovir alafenamide fumarate for preventing mother-to-child transmission of hepatitis B virus: A national cohort study[J]. Aliment Pharmacol Ther, 2020, 52(8): 1377-1386.
[15]YIN X, HAN G, ZHANG H, et al. A real-world prospective study of mother-to-child transmission of HBV in China using a mobile health application (shield 01)[J]. J Clin Transl Hepatol, 2020, 8(1): 1-8.
[16]Polaris Observatory Collaborators. Global prevalence, treatment, and prevention of hepatitis B virus infection in 2016: A modelling study[J]. Lancet Gastroenterol Hepatol, 2018, 3(6): 383-403.
[17]CUI F, WOODRING J, CHAN P, et al. Considerations of antiviral treatment to interrupt mother-to-child transmission of hepatitis B virus in China[J]. Int J Epidemiol, 2018, 47(5): 1529-1537.
[18]National Health and Family Planning Commission of the People’s Republic of China. Action plan to prevent mother-to-child transmission of AIDS, syphilis, and hepatitis B (2015)[EB/OL]. (2015-4-19)[2021-02-01]. http://www.nhc.gov.cn/ewebeditor/uploadfile/2015/06/20150615151817186.docx.
国家卫生和计划生育委员会. 预防艾滋病、梅毒和乙型肝炎母婴传播工作实施方案 (2015年版)[EB/OL].(2015-4-19)[2021-02-01]. http://www.nhc.gov.cn/ewebeditor/uploadfile/2015/06/20150615151817186.docx.
[19]PAN CQ, ZOU HB, CHEN Y, et al. Cesarean section reduces perinatal transmission of hepatitis B virus infection from hepatitis B surface antigen-positive women to their infants[J]. Clin Gastroenterol Hepatol, 2013, 11(10): 1349-1355.
[20]PENG S, WAN Z, LIU T, et al. Cesarean section reduces the risk of early mother-to-child transmission of hepatitis B virus[J]. Dig Liver Dis, 2018, 50(10): 1076-1080.
[21]CHEN HL, CAI JY, SONG YP, et al. Vaginal delivery and HBV mother to child transmission risk after immunoprophylaxis: A systematic review and a meta-analysis[J]. Midwifery, 2019, 74: 116-125.
[22]SCHILLIE S, VELLOZZI C, REINGOLD A, et al. Prevention of hepatitis B virus infection in the United States: Recommendations of the advisory committee on immunization practices[J]. MMWR Recomm Rep, 2018, 67(1): 1-31.
[23]CHEN X, CHEN J, WEN J, et al. Breastfeeding is not a risk factor for mother-to-child transmission of hepatitis B virus[J]. PLoS One, 2013, 8(1): e55303.
[24]SHI Z, YANG Y, WANG H, et al. Breastfeeding of newborns by mothers carrying hepatitis B virus: A meta-analysis and systematic review[J]. Arch Pediatr Adolesc Med, 2011, 165(9): 837-846.
[25]EHRHARDT S, XIE C, GUO N, et al. Breastfeeding while taking lamivudine or tenofovir disoproxil fumarate: A review of the evidence[J]. Clin Infect Dis, 2015, 60(2): 275-278.
[26]YI W, PAN CQ, LI MH, et al. The characteristics and predictors of postpartum hepatitis flares in women with chronic hepatitis B[J]. Am J Gastroenterol, 2018, 113(5): 686-693.
[27]Antiretroviral Pregnancy Registry Interim Report for 1 January 1989-31 January 2020[EB/OL]. [2021-02-01]. http://www.apregistry.com/forms/exec-summary.pdf.
[28] WEN WH, CHEN HL, SHIH TT, et al. Taiwan Study Group for the Prevention of Mother-to-Infant Transmission of HBV (PreMIT study). Long-term growth and bone development in children of HBV-infected mothers with and without fetal exposure to tenofovir disoproxil fumarate[J]. J Hepatol, 2020, 72(6):1082-1087.