
15亿年前,真菌便已广泛存在于这片蓝色星球上,伴随着生命的演化真菌不断繁衍生息。也许你从未注意,你的生活已被真菌包围;这些不起眼的微生物,掌握着生死存亡的关键,甚至改变了人类文明的发展进程!目前已鉴定出的40万种真菌菌属[1]中约300多种[2]是“隐藏的致命杀手”,不但可以致病,甚至还可导致死亡。
侵袭性真菌病(IFD)是真菌感染的重要类型,发病率不断增加[3];且从“超级真菌”到“COVID-19相关真菌感染”,IFD已成为了全球性的致命威胁,引发临床的广泛关注[4-5]。

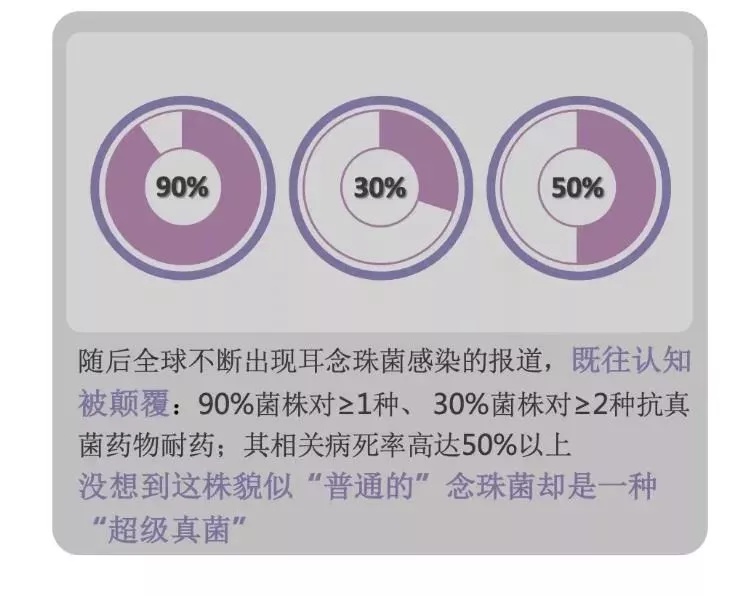
随着环境的改变、诊断技术的发展,IFD的流行病学不断改变,耐药真菌、罕见真菌检出率的增加使IFD的诊疗面临全新挑战[3,6]。虽然酵母菌是临床常见致病真菌,但就在这些“习以为常“之中却存在着许多“改变”:

因此,当前IFD的治疗时应综合患者免疫状态、感染菌种等多种因素进行综合评估。
念珠菌病:面临菌谱改变及耐药的双重压力,是时候考虑调整最佳临床管理策略
侵袭性念珠菌病在全球范围内的发病率呈明显上升趋势。既往白念珠菌是最常见的念珠菌菌株,但近年来非白念珠菌检出率逐渐增加,并导致药物敏感性降低和耐药菌感染暴发。侵袭性念珠菌病诊断困难,早期经验抗真菌治疗是改善患者预后的重要措施[7-8]。
1、非白念珠菌及耐药念珠菌检出率令人担忧;罕见念珠菌检出率不断增加
非白念珠菌的流行病学转变已达到令人担忧的趋势。不同念珠菌属的发生率因地域、年龄、患者易感因素、当地医院流行病学和抗真菌药物的应用不同而存在差异。白念珠菌在北欧、中欧和美国所占比例较高,而非白念珠菌在南美洲、亚洲和南欧更为常见[1,9];在我国,检出的念珠菌中近70%为非白念珠菌[10-11]。而当前COVID-19疫情下,非白念珠菌甚至已成为全球的主要念珠菌菌株[12]。近平滑念珠菌、热带念珠菌和光滑念珠菌是前三位检出的非白念珠菌[9-11]。
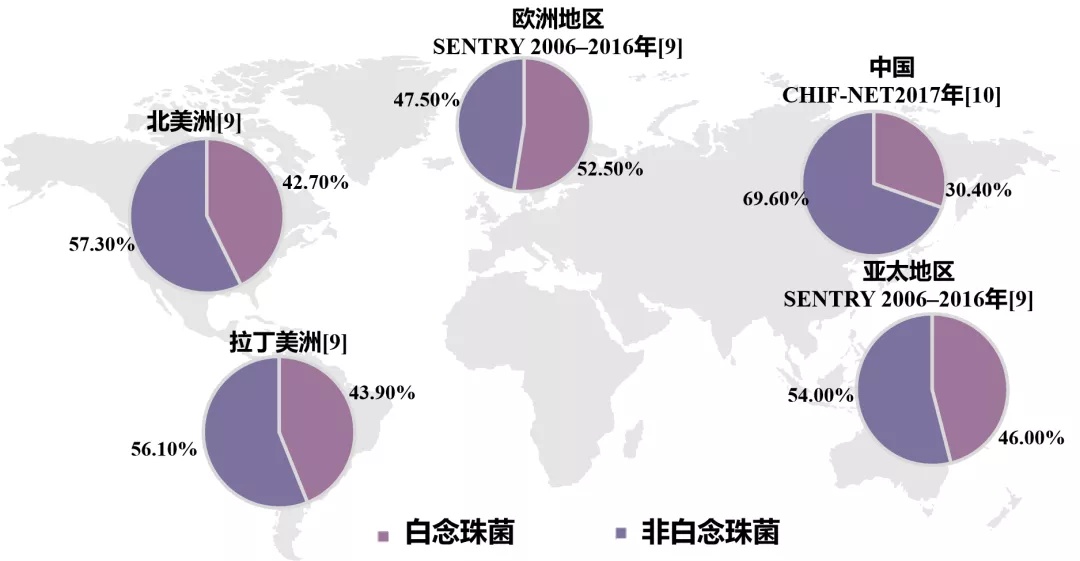
图1.SENTRY及CHIF-NET监测数据:白念珠菌和非白念珠菌检出率[9-10]


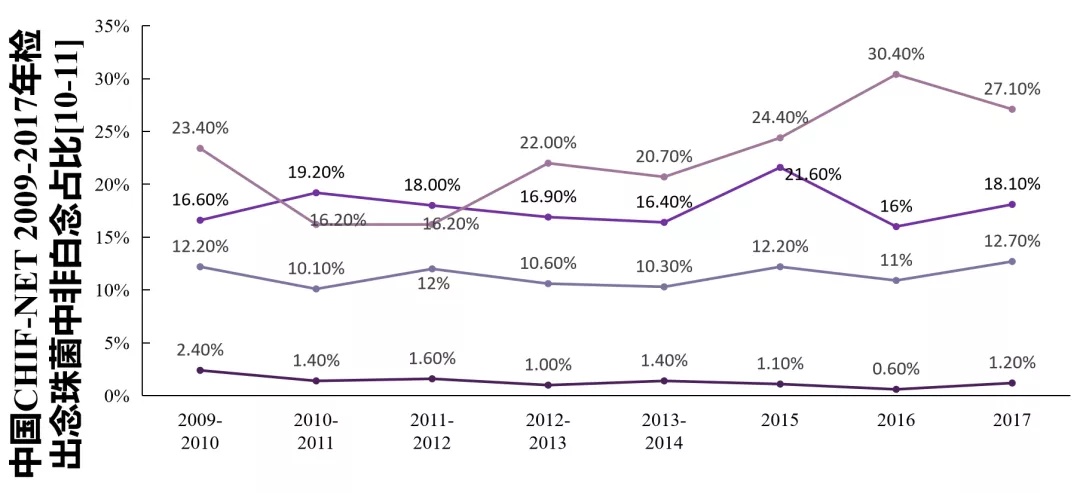
图2.SENTRY及CHIF-NET监测数据:检出念珠菌中非白念珠菌占比[9-11]
念珠菌耐药问题严峻。唑类和棘白菌素类药物的大量应用导致了念珠菌的选择性压力,从而导致耐药菌(包括多重耐药菌)检出率显著增加[13-15]。不同研究显示:近平滑念珠菌、热带念珠菌、光滑念珠菌对唑类药物的耐药率约为15%-33%[14-16];光滑念珠菌对棘白菌素的耐药率达10%以上[15],近年来甚至还检测到泛棘白菌素耐药的热带念珠菌和光滑念珠菌[10]。
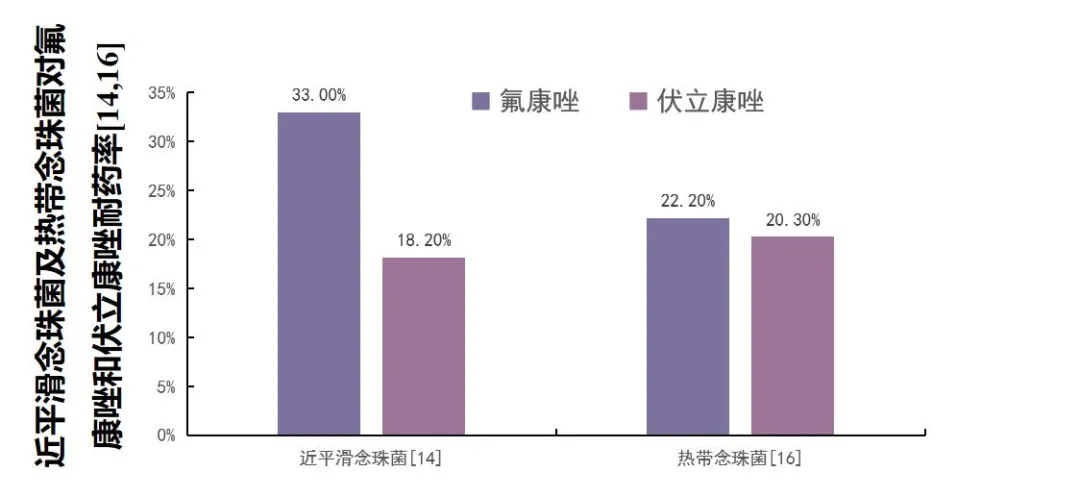
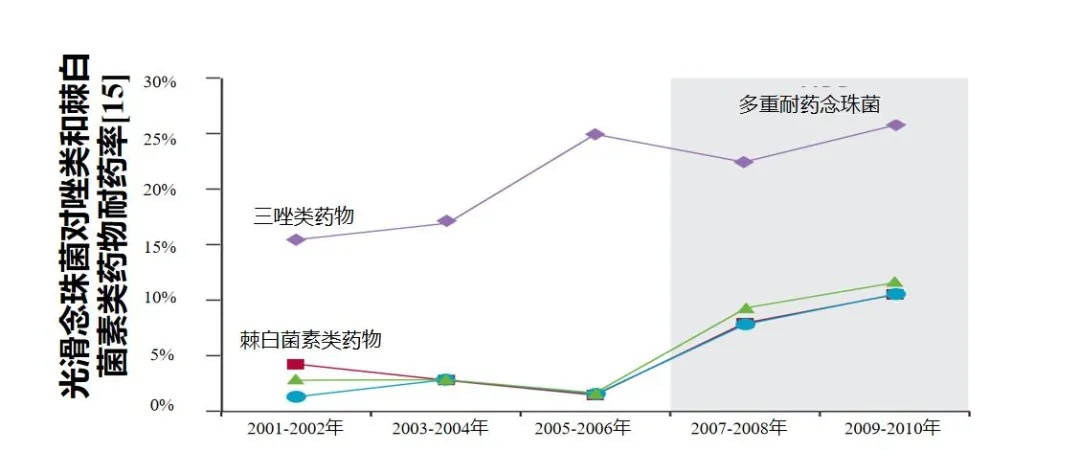
图3.不同念珠菌菌株对唑类和棘白菌素类药物的耐药率
罕见念珠菌已引起广泛关注。罕见念珠菌检出率不断增加,且唑类和棘白菌素类药物的最低抑菌浓度(MIC)较高,而两性霉素B的抗菌谱及抗菌活性最优[17]。耳念珠菌作为最著名的罕见念珠菌,已在全球范围内出现,并引起多地“超级真菌”疫情暴发。耳念珠菌对目前临床常用抗真菌药物的耐药率均较高,甚至在高浓度棘白菌素类药物暴露下出现反常生长现象,为治疗带来巨大挑战[18-20]。
表1.与临床常见念珠菌折点相比,常用抗真菌药物对罕见酵母菌MIC值[17]
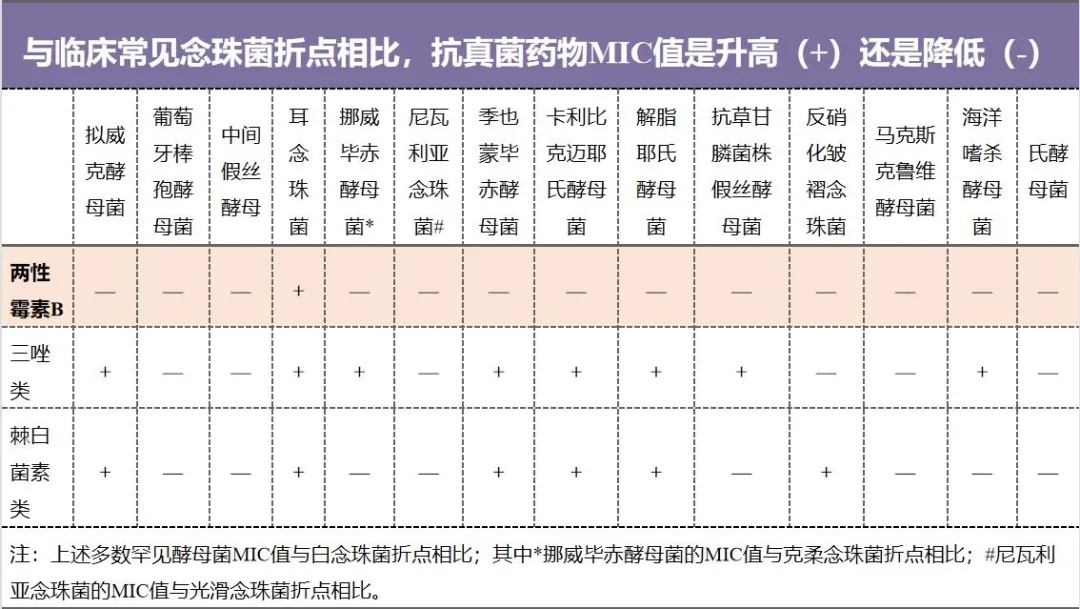
2、侵袭性念珠菌病诊断困难,经验治疗时应依据流行病学现状选择适当抗真菌药物
目前念珠菌的诊断仍较为困难,血培养、G试验等均存在一定不足,但多种新型诊断技术正在不断探索与研究[19]。T2念珠菌纳米诊断、白色念珠菌菌管抗体测定(CAGTA)、直接对临床标本的PCR检测、宏基因检测等已逐渐用于侵袭性念珠菌病的诊断,甚至被指南推荐作为临床诊断方法[21-23]。
早期识别和迅速开始适当的全身抗真菌治疗是降低侵袭性念珠菌病死亡率的关键[8]。目前指南推荐棘白菌素类、氟康唑、两性霉素B脂质体等用于侵袭性念珠菌病的治疗[24-27]。但多项研究发现:初始接受氟康唑治疗的念珠菌血症患者中,多数为不适当的治疗(56%为非白念珠菌感染,10.6%为氟康唑耐药菌感染)[28];此外,在接受氟康唑或棘白菌素类药物经验性治疗的ICU非粒缺患者中,最终未获得显著的生存获益[8]。针对当前侵袭性念珠菌病的流行病学特点,是时候考虑调整患者最佳临床管理的新策略了[8]:
1.耐药念珠菌感染:应选择两性霉素B或伏立康唑治疗[27]。
2.罕见酵母菌感染:一线治疗选择两性霉素B脂质体,伏立康唑作为备选方案;二线治疗应选择与一线方案不同类的抗真菌药物;多种罕见酵母菌感染时,应避免使用棘白菌素类药物[29]。
隐球菌病:应对发病率增高的巨大挑战,践行以菌种为重点的综合管理
自获得性免疫缺陷综合征(AIDS)流行以来,隐球菌已成为一种日趋高发的病原体;随着肿瘤、实体器官移植等其它免疫缺陷宿主的增加,隐球菌在非人类免疫缺陷病毒(HIV)感染患者的发生率也不断上升[30-32]。格特隐球菌和新型隐球菌是临床主要菌株,但近年来罕见隐球菌菌株也不断出现[30]。长期适当的抗真菌药物治疗,同时结合颅内压管理及宿主免疫功能改善是治疗隐球菌病的主要方法[31]。
1、更多发生于无显著可识别的免疫缺陷患者,且已出现耐药问题
隐球菌病可发生在更多无显著可识别的免疫缺陷患者中。隐球菌病是全球最常见的致死性真菌病;每年有超过100万的隐球菌感染患者,其中约65万隐球菌感染患者死亡[33]。既往HIV感染是隐球菌病的重要危险因素;有报道称:全球每年约18.11万人死于人类免疫缺陷病毒(也称艾滋病毒,HIV)相关隐球菌脑膜炎,占所有HIV死亡患者的15%[31]。近年来,更多研究发现,隐球菌病在非HIV感染患者中同样高发,如:器官移植、恶性肿瘤、糖尿病、需接受免疫抑制治疗的疾病等[33]。随着对疾病认识的提升,更多数据证实,隐球菌病(尤其是独立的肺部感染)可发生在无任何可显著识别的免疫缺陷患者中(非HIV非移植患者)[33]。新近研究显示:确诊隐球菌病患者中,仅20%和10%的患者存在HIV感染和器官移植,而70%的隐球菌病患者为非HIV非移植人群[30];糖尿病、慢性肝病、慢性肾病、慢性肺病等是隐球菌病患者的常见基础疾病[33]。
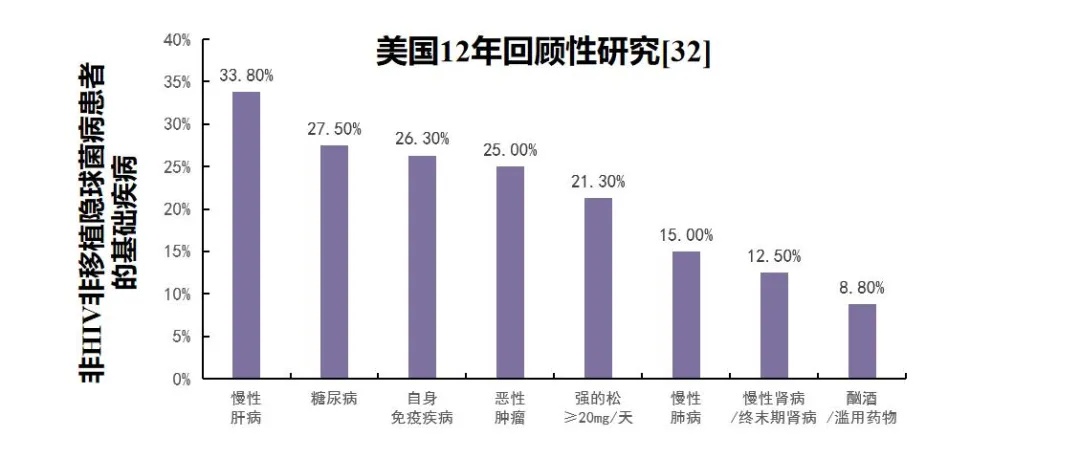
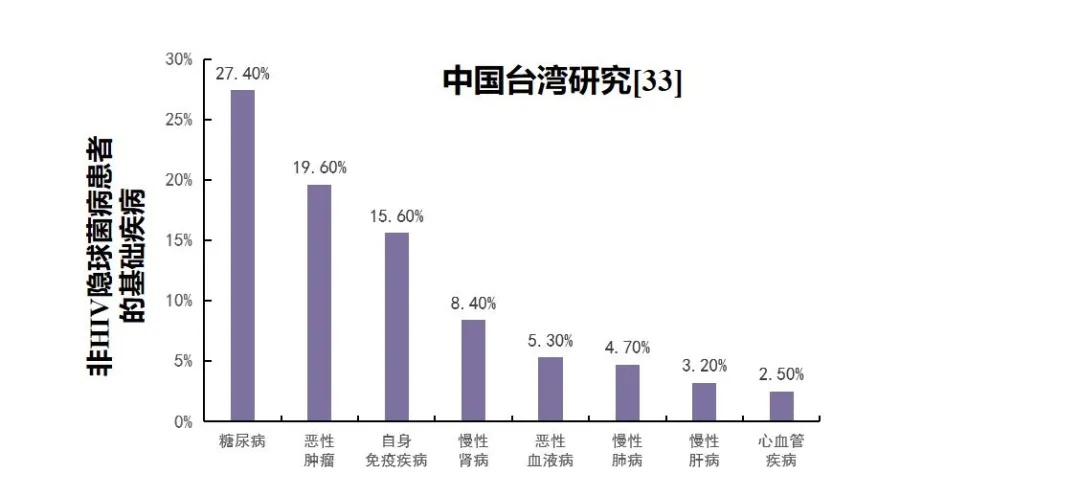
图4.非HIV非移植隐球菌病患者危险因素[32-33]
隐球菌的耐药问题已出现。格特隐球菌和新型隐球菌是临床主要菌株,既往数据提示新型隐球菌对氟康唑、伏立康唑、两性霉素B均保持较高的敏感率;但近年来,既往罕见隐球菌菌株和耐药菌株不断出现[30,34]。我国新近研究发现:在长江三角地区出现了7种既往未被报道过的隐球菌菌株,且同时还在检测到对氟康唑和伊曲康唑耐药的隐球菌菌株[34]。
2、治疗应以菌种为重点,综合感染部位、疾病严重程度、患者免疫状态等多种因素
隐球菌病的诊断包括显微镜检、血清学检测和培养;其中,隐球菌荚膜多糖抗原检测具有较高的敏感性和特异性,是目前临床常用的诊断方法[30-31]。此外,PCR-指纹图谱、AFLP基因分型、微卫星分型、多位点测序分型和全基因组测序等目前也被广泛用于隐球菌的分子流行病学监测研究[30]。
隐球菌病的治疗需综合考虑感染部位、疾病严重程度和患者潜在的免疫状态[31]。此外,由于不同隐球菌菌株敏感性存在差异;因此未来的治疗应以菌种为重点,而非复合体[30-31]。
1)HIV感染患者隐球菌病:2周两性霉素B(包括两性霉素B脂质体、两性霉素B脱氧胆酸盐)+5-氟胞嘧啶作为诱导方案,随后氟康唑维持治疗[30-31]。
2)移植患者隐球菌病:两性霉素B脂质体+5-氟胞嘧啶作为诱导方案,随后氟康唑维持治疗[31]。
3)非HIV非移植患者隐球菌病:目前很少有前瞻性研究指导此类患者的治疗,临床常依据HIV感染患者的研究结果进行调整[31]。
医疗技术的进步使IFD高危患者数量不断增加,作为最常见致病真菌,酵母菌感染发病率同样也显著增加。但高危患者群的改变及抗真菌药物的大量应用同时带来了意料之外的改变——耐药酵母菌、罕见酵母菌检出率不断增加。针对上述意料之外的酵母菌感染流行病学现状,临床管理策略同样应适时调整,当前酵母菌的治疗应以菌种为依据,选择可有效覆盖耐药菌、罕见菌且活性强的抗真菌药物。