统计数据表明,在世界范围内,慢性疼痛影响着 19% 至 50% 的人口,目前人们通常依赖于阿片类药物来治疗慢性疼痛。然而,阿片类药物有着 「严重的成瘾风险」 的不良副作用,且随着使用时间的延长,阿片类药物也会增加人们对疼痛的敏感性,导致他们越来越依赖更高剂量的用药。
令人鼓舞的是,2021 年 3 月 10 日,美国加州大学圣地亚哥分校的研究人员在国际顶尖学术期刊 Science 子刊 Science Translational Medicine 上发表了题为:Long-lasting analgesia via targeted in situ repression of NaV1.7 in mice 的研究论文。
研究团队使用切割活性丧失的 Cas9 蛋白(dCas9),暂时阻断了一种名为 NaV1.7 的基因,并以此成功降低了实验小鼠对疼痛的敏感性。更重要的是,这种缓解疼痛的效果可以持续数个月,且无明显副作用。

CRISPR 技术的兴起使人类能够以自己的意志去改变基因的表达模式。不仅如此,越来越多的 CRISPR 基因编辑工具正在涌现,目前 CRISPR 技术不仅在基因编辑领域大显身手,还在核酸定位、核酸检测和癌症治疗等领域也展现出良好的应用前景。
与此同时,此前有研究表明,NaV1.7 基因编码的钠离子通道蛋白在脊髓中传递疼痛的神经元中表达,且对于缺乏功能性 NaV1.7 的人来说,像触摸热的、尖锐的东西这样的感觉不会被记录为疼痛。相反,NaV1.7 的过度表达反而会使人感受到更多的疼痛。
更关键的是,NaV1.7 基因似乎只与疼痛有关,将其敲除或突变目前没有观察到任何严重的副作用。
基于此,Ana Moreno 等人提出了利用 CRISPR 技术靶向抑制 NaV1.7 基因表达以此治疗慢性疼痛疾病的研究假设。在此项研究中,研究人员使用了一种缺乏切割活性的 dCas9 蛋白,该蛋白仍可可以在 gRNA 的引导下结合到靶标基因上,并抑制该基因的表达。

在小鼠中通过 RAB-dCas9 和 ZFP-KRAB 原位抑制 NaV1.7 的示意图
紧接着,研究团队在实验小鼠身上进行了脊髓注射来测试这个系统,这些小鼠因炎症或化疗而引起了慢性疼痛症状。令人鼓舞的是,研究人员发现,接受治疗的小鼠比对照组小鼠表现出更高的疼痛阈值。具体表现为,经过治疗的小鼠在疼痛刺激(如热、冷和受压等)下撤回爪子的速度更慢,而且它们在受伤后舔或摇动爪子的时间也更少。
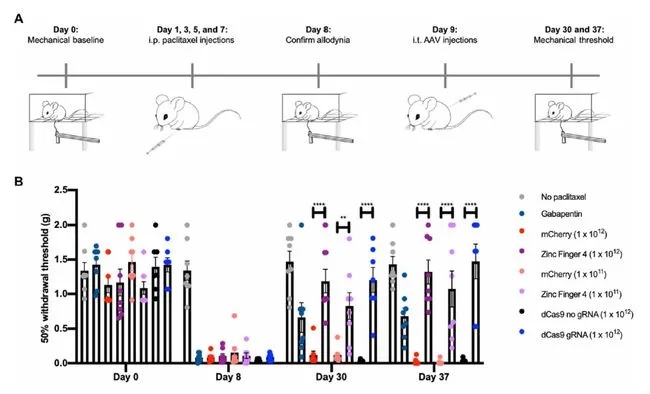
接受治疗的小鼠比对照组小鼠表现出更高的疼痛阈值
研究人员还测试了治疗效果的持续时间,他们发现,炎症性疼痛小鼠在治疗 44 周后仍然有效,化疗性疼痛小鼠在 15 周后仍然有效。Moreno 表示,药效持续时间仍在评估中,预计会持续很长时间,并且接受治疗的小鼠没有丧失痛觉敏感性或显示出任何非正常运动功能的变化。
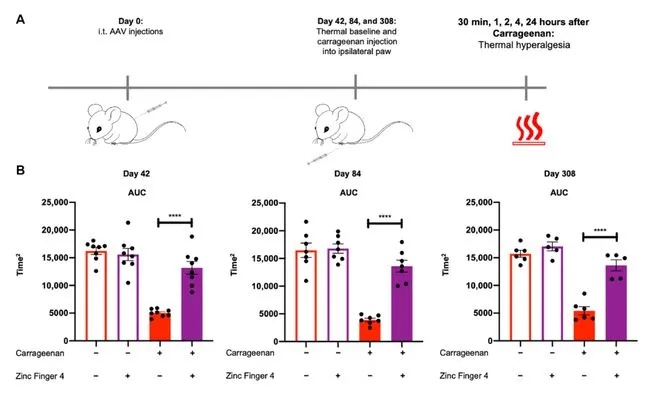
药效持续时间可以持续数个月
不仅如此,为了进一步验证他们的结果,研究团队随后使用锌指蛋白基因编辑工具 ——ZFP-KRAB 进行了测试,产生了与 KRAB-dCas9 系统相同的结果。
事实上,此前也有研究开发特异性靶向 NaV1.7 蛋白的化合物或抗体,但许多靶向 NaV1.7 的小分子药物往往因缺乏靶向特异性或生物利用度有限而失败,此外,抗体也面临着类似的情况。因此,可以毫不夸张地说,这项研究是一项变革性的成果!
本研究的通讯作者 Prashant Mali 教授表示:这项研究打开了用基因疗法治疗常见疾病和慢性疾病的大门。一些常见疾病往往源基因的错误表达,如果可以减少这种基因的表达水平,就可以把它降至一个不致病的水平。这就是该研究所做的 —— 并不是完全消除疼痛表型,而是抑制它。
总而言之,这项研究提出了一种基于 CRISPR-dCas9 系统开发的原位表观遗传治疗方法,在长时间缓解实验小鼠的疼痛症状的同时,而不会引起明显副作用,以此提出了一种可行的阿片类药物替代策略,为广大被慢性疼痛困扰折磨的患者带来的福音!
参考资料:
1.https://stm.sciencemag.org/content/13/584/eaay9056.full
2.https://www.genengnews.com/news/dead-cas9-crispr-epigenetic-repression-provides-opioid-free-pain-relief-with-no-side-effects/