
导读
随着早期CT筛查普及,亚实性多原发肺癌(MPLC)检出率逐渐提升。MPLC往往为多中心起源,单纯手术治疗无法完全清除所有原发病灶,需要通过系统性治疗控制其它原发病灶。然而,由于不同原发灶间具有异质性,单纯靶向治疗无法有效控制不同原发病灶,甚至可能因靶向治疗高选择性导致其余病灶过早出现耐药克隆,影响后续治疗疗效。目前,已有多项研究在早期非小细胞肺癌(NSCLC)的新辅助免疫治疗中显示出令人鼓舞的结果,那么,MPLC这一类特殊群体能否同样从免疫新辅治疗中获益?
近日,广东省肺癌研究所与世和基因合作,采用世和基因NGS检测技术,首次报道了一例接受帕博利珠单抗新辅助治疗的早期双肺MPLC患者,揭示了病灶间基因组和免疫微环境的异质性对免疫治疗应答差异,相关研究成果发表于癌症免疫治疗学会(SITC)官方期刊《Journal for ImmunoTherapy of Cancer》(IF=10.252)。
正文
患者,女,72岁,CT检查发现双侧多发肺结节,穿刺病理显示左上叶一实性结节后确诊为肺腺癌,其它双肺结节为混合性或纯磨玻璃结节,PET扫描未发现远处转移或高摄取的肿大淋巴结。NGS检测实性结节未发现常见驱动基因突变,Dako 22C3检测PD-L1表达TPS为40%。外院考虑肺内转移可能,遂予帕博利珠单抗治疗三个疗程,后复查胸部CT显示实性结节(W2)临床疗效评估为PR(-31.8%),混合和纯磨玻璃结节(W1和W3)临床疗效评估为增大SD(图1A)。行左上肺肺叶切除术+肺门纵隔淋巴结清扫术,并对左上肺主要病灶及部分混杂/纯磨玻璃病灶进行多组学检测探究免疫应答差异机制。
多重荧光免疫组化(mIHC)揭示免疫应答差异机制
通过mIHC对三个结节的多种淋巴细胞、巨噬细胞、NK细胞进行原位染色,结果显示应答结节W2有更高浸润的CD8+ T淋巴细胞和活化的CD68 + HLA-DR + M1巨噬细胞。值得注意的是,CD20染色在3个结节中均发现三级淋巴样结构(TLS)形成,并且在Non-responder(无应答组,W1/W3)中观察到的TLS密度小于Responder(应答组,W2),这些与已报道的免疫响应机制较为吻合(图1B)。

图1 患者3个结节免疫治疗前后影像结果和mIHC染色图
瘤间基因组及TCR异质性
WES结果显示W1和W3均检测到EGFR L858R突变,而W2则检测到KRAS的致癌驱动基因突变(图2A)。W1和W2在染色体层面的CNV发生事件比W2更多,染色体不稳定性(CIS)比W2更高,TMB则低于W2。3个结节在HLA分型预测新抗原方面具有较大的异质性(图2B),W2新抗原的数量最多。无论是驱动突变的检出,还是TMB、新抗原、CIS,都验证了W1和W3不响应的机制。
TCR测序结果显示W2具有更高的CDR3克隆多样性,Shannon指数也较W1和W3低(图2C、D)。并且,W2中有一种较高比例的CDR3克隆序列(CAISLKSSGFTGELFE),占总谱库的10%以上,该序列可能与W2免疫应答有关。
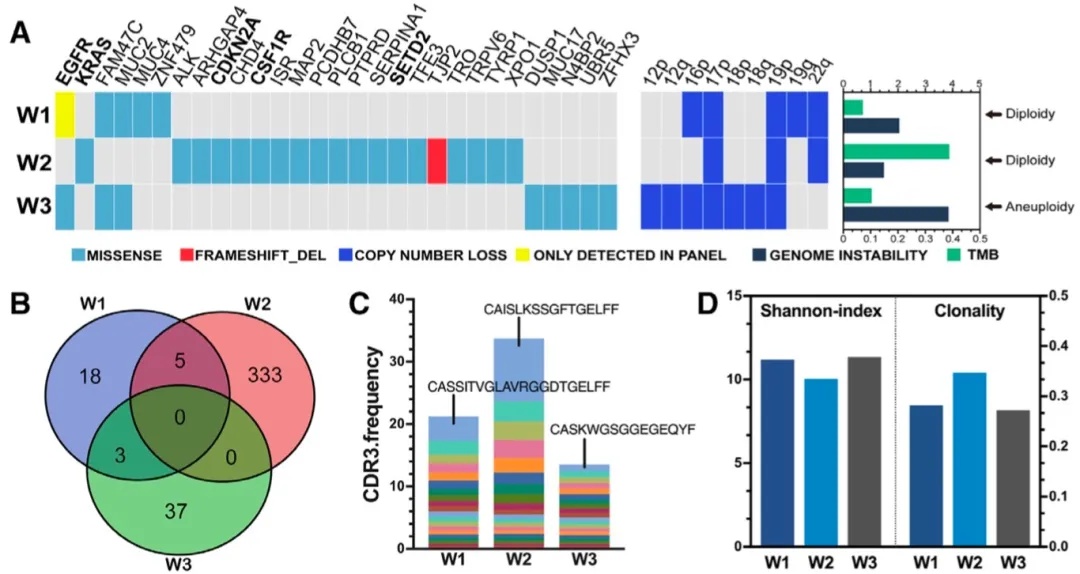
图2 患者3个结节WES和TCR分析图
单细胞RNA测序揭示免疫应答差异机制
单细胞RNA测序分析基因差异表达,发现在W2中HLA、补体激活和免疫调节相关的基因显著上调,而在W1/W3中,细胞生长和粘附相关的基因显著上调(图3E)。对可能介导系统性治疗耐药相关通路表达情况进行分析,发现免疫治疗有效肿瘤细胞具有更高脂肪酸代谢相关基因表达,而介导上皮间充质化相关基因表达水平无明显差异(图3F)。GO通路分析进一步证实W2在抗原的加工和呈递通路、T细胞介导的细胞毒性和其它T细胞活化通路中显著富集;而W1/3肿瘤细胞则显著富集于生长因子受体的信号传导和细胞增殖通路(图3G),部分解释了免疫治疗差异性应答。

图3 单细胞测序差异表达分析结果(W2红色,W1/3蓝色)
另外,通过特征性标记(CD3+ CD8+ CD45+) 将来自3个结节的2755个CD8+ T淋巴细胞进行非监督聚类和细胞类群注释(图4A、B)。通过拟时序分析构建CD8 T细胞分化趋势图,显示存在两条不同细胞分化命运,其中免疫应答组W2中CD8 T细胞主要富集Fate2细胞类群,而无应答组W1/W3则主要富集Fate1细胞类群(图4C)。功能富集分析显示,Fate2细胞更多是抗原特异性细胞毒性T细胞,而Fate1缺少经MHC I类相关抗原呈递信号通路表达水平(图4D)。
此外,我们在W2中发现组织驻留性记忆性T细胞(Trm)亚群显著富集,约占T淋巴细胞的50%。既往研究显示,Trm存在于上皮、结缔组织和其他组织中,与癌症预后存在一定相关性。通过对这一类Trm细胞进行biomarker筛选分析构建Trm相关标签(signature),并结合已发表的免疫治疗相关数据队列和TCGA肺癌/黑色素瘤队列数据,进一步验证Trm signature免疫治疗疗效预测和预后价值,结果提示Trm signature可以作为免疫治疗前/后疗效预测及预后预测biomarker(图4E)。
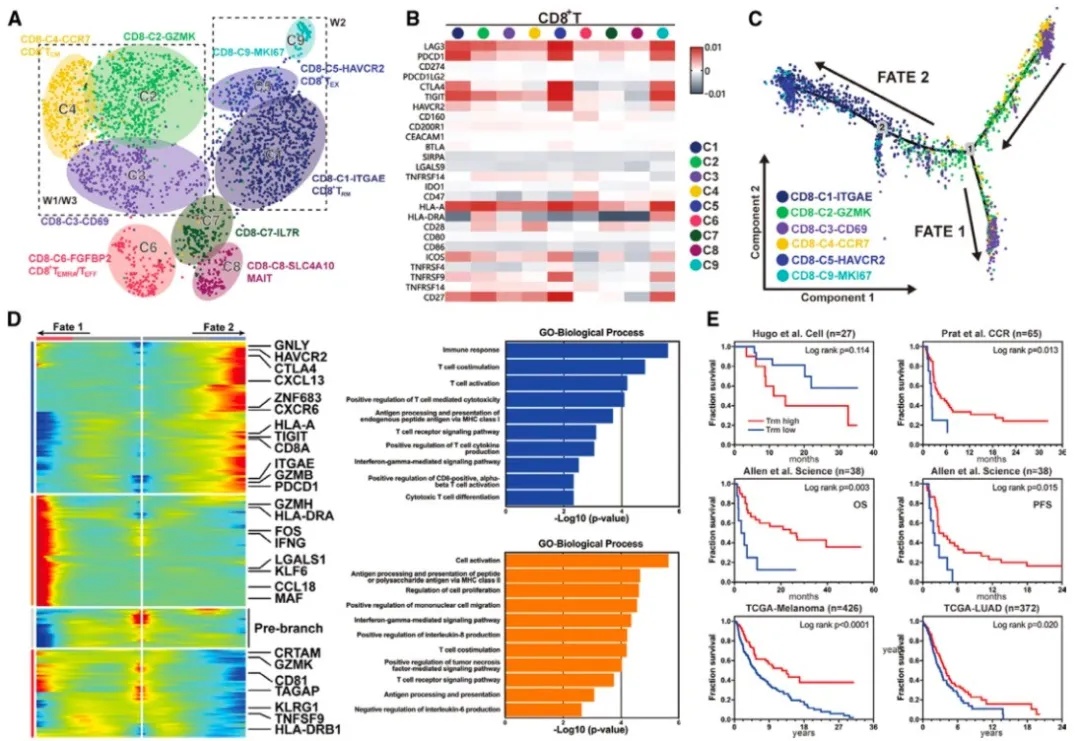
图4 单细胞测序细胞聚类图、细胞演化趋势及功能富集分析、外部队列验证结果
总结
多原发性肺癌具有高度异质性,其临床诊疗一直存在诸多挑战。近期一项发表在CTM杂志的研究及去年ESMO会议poster研究均显示,在合并多发含磨玻璃样成分结节的晚期肺癌中,免疫治疗对亚实性病灶整体疗效并不佳。
本研究首次在早期MPLC且有病理明确多原发肺腺癌中,结合多组学分析技术阐述了不同原发性病灶对免疫治疗应答差异机制,并通过多个已发表的高质量外部数据队列验证,提出基于Trm signature作为免疫治疗疗效/预后预测biomarker。本研究针对特殊人群免疫治疗加上多维度检测方法,为单病例免疫治疗研究提供了较全面的方法学范例。