■ 从宽松到风险控制下的协调发展政策信号
根据综述(DOI:10.1038/s41434-020-0163-7),我国早在1993年就首次出台了基因治疗方面的监管政策,经历了三个阶段的演变:
1)20世纪末,监管相对宽松,技术和药物的两条监管路径
1993年,国家科学技术委员会发布了“基因工程安全管理措施”,但该规则并未具体规定有关基因治疗的详细规定。同年,卫生部药品监督管理局发布了《人体体细胞疗法和基因疗法临床研究质量控制要点》,为基因疗法提供了具体的质量控制指南;1999年,国家药品监督管理局颁布了《新生物产品批准办法》和《药物临床试验管理标准》,将基因治疗纳入了新生物产品和药物临床试验的监管范围。
2)2000-2015年,监管仍宽松,监管范围扩大
监管范围涉及基因治疗的药物临床试验、质量控制、辅助生殖、伦理审查、干细胞治疗等。2009年,卫生部发布了医疗技术临床应用管理办法,将基因治疗列为第三类医疗技术。特别的,2003年,卫生部根据《人类辅助生殖技术管理办法》(2001年),制定了禁止以生殖为目的进行基因治疗临床试验的政策。
3)2016年至今,风险控制下协调发展
受“基因编辑婴儿”事件的影响,中国正在加强生物安全、基因技术、生物医药等领域的立法。特别地,将胚胎基因编辑纳入刑法。《生物安全法》的颁布提上日程。
■ 我国1993-2019年基因治疗政策
综述列举了我国自1993-2019年基因治疗的监管政策(如下图1),对照FDA相关政策对照。可以看出,自2016年后,我国政策相对保守同时宏观。FDA连续颁布了基因治疗的微生物载体、视网膜疾病、罕见病、血友病等相关的学术及工业指导(Guidance)。

图1:1993-2019年我国基因治疗的监管政
(来源:Yu Jia Cai et al. Gene Therapy)
受个别事件的影响,受基因编辑技术牵连的基因治疗领域与政策强关联,而针对体细胞基因编辑以及寡核苷酸疗法等方式的基因治疗,仍需细化政策指引。
二、基因治疗临床研究:相对落后
在基因治疗的发展早期,核心痛点是缺乏有效的载体工具将外源基因递送到细胞中。这一问题直到20世纪80年代病毒载体被发明得以推动。但正如大部分新兴技术而言,关键技术突破后的"非理性狂热“后导致1999-2000年数个恶性事件发生——1名18岁的男孩在接受基于腺病毒载体的基因治疗后死于严重的炎症反应。次年,使用基于gammaretroviral vector(一种病毒载体)的基因疗法治疗X连锁重症联合免疫缺陷症(SCID-X1)导致了近半数患者患上了T细胞白血病——之后的12年,随着全球产业环境及政策的”回声“,临床研究和产业的热潮褪去。
打破寂静,带来基因治疗新的春天的消息是,2012年Glybera在欧洲获得批准——来自荷兰一个中小企业UniQure开发,全球第一个针对遗传性疾病(脂蛋白脂肪酶缺乏症)的基因治疗产品。尽管它价格高昂(111万欧元),获批四年仅使用一次,但它带来的市场效应远大于自身销售价值。紧接着,超过10款基因疗法产品在全球获批上市(如图2)。
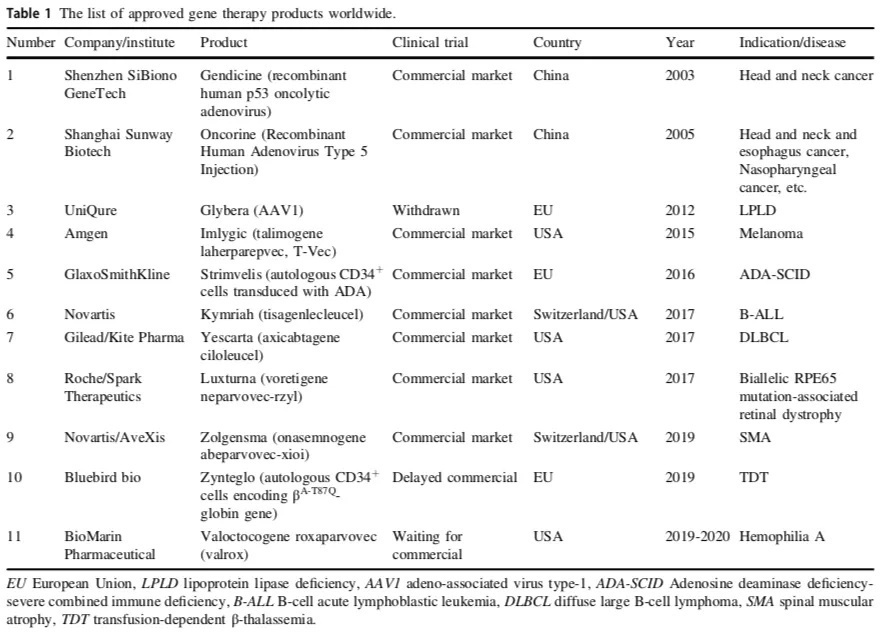
图2:2003-2020年全球批准的基因治疗药
(来源:Yu Jia Cai et al. Gene Therapy)
对于我国,在基因治疗研究的”非理性狂热“阶段,我国在1991年开展了全球第二项基因治疗临床试验(针对血友病B),并在2003批准了世界上首款基因治疗产品Gendicine(用于治疗晚期头颈癌的重组人p53腺病毒注射液,又名”今又生“)。尽管”今又生“定价3380元一针,仍然无法进医保,让患者难以支付,同时遭遇知识产权纠纷以及市场困境,终究成为尴尬的第一。而此后至今,我国尚没有一款基因治疗产品获批上市。据综述,相关临床试验近20余项(对比FDA的IND申请超过900余项)。
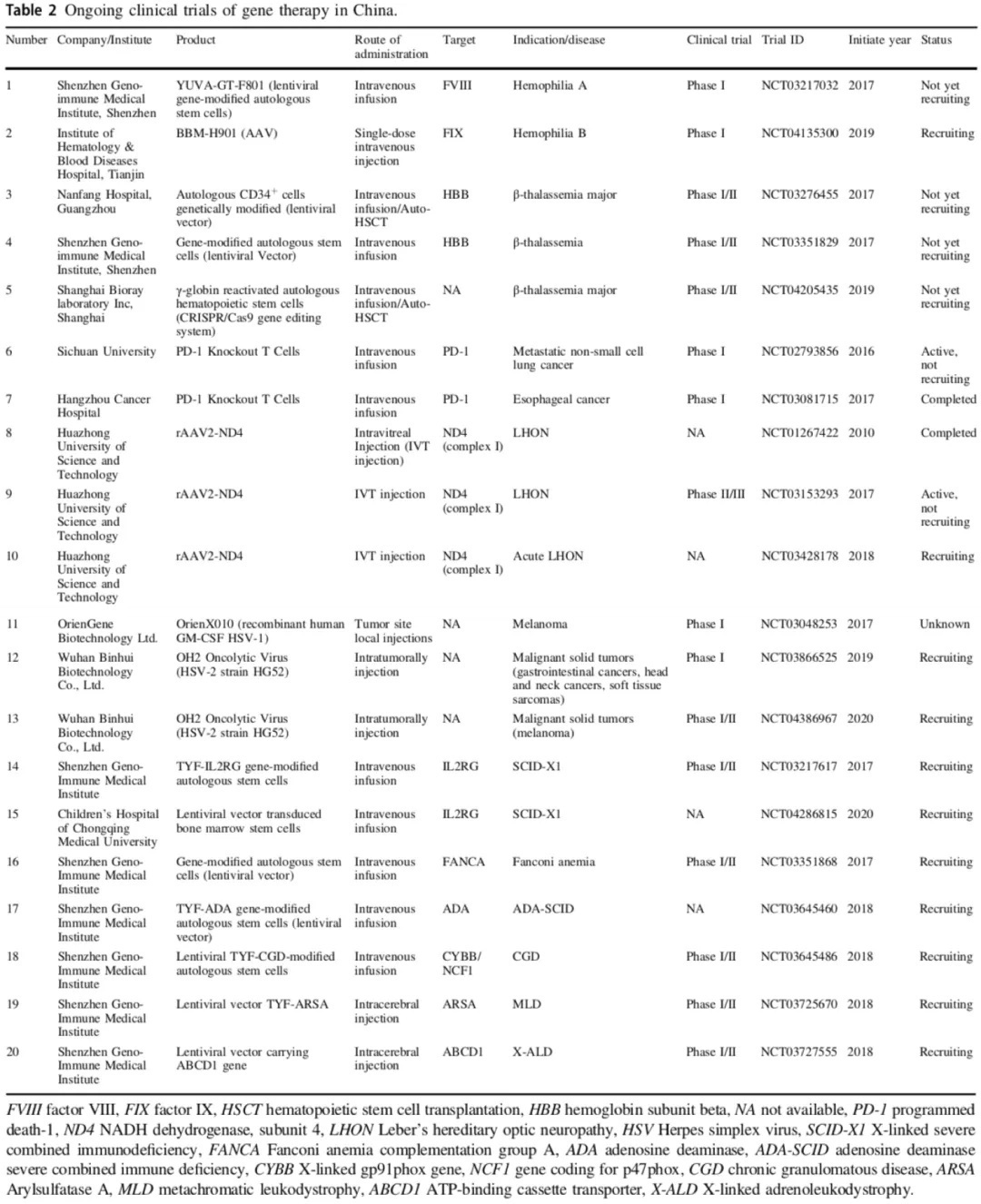
图3:我国正在进行基因治疗临床试验
(来源:Yu Jia Cai et al. Gene Therapy)
三、基因治疗技术产业发展:市场亟需,前景可期
广义的基因治疗,是癌症治疗的主流技术之一,更是我国两广地区高发的地中海贫血、血友病、囊性纤维病等其他遗传性疾病(或罕见病)的重要治疗方法。以下举两例来说明当前需求和进展。
■ 血友病
据报道,我国血友病患者超10万人,而且尽管按照75高报销比例的地区来看,每年的检查和理疗费用达到8万元。尚无有效的治疗方法。
我国虽然早在1991开展的首个血友病基因治疗临床试验针对的就是血友病,但直到26年后,才出现新的临床试验开展,例如NCT04135300(静脉输注基于AAV的基因疗法BBM-H901用于治疗血友病B)、NCT03217032(慢病毒FVIII基因修饰HSPC移植用于治疗血友病A),状态均在临床试验入组过程或更早阶段。
对照全球情况有较大的差距。2019年,美国制药企业拜玛林(BioMarin Pharmaceutical)(Nasdaq:BMRN)宣布,旗下全球首个血友病基因疗法valoctocogene roxaparvovec获欧洲药监局加速审批资格;2020年,FDA推迟其生物制品许可申请,获批时间预估最早至2021年底上市。
■ β-地中海贫血
根据我国发布的《重型β地中海贫血的诊断和治疗指南(2017年版)》,我国每年至少有上万例重型β地贫患儿出生,严重的慢性进行性贫血,需依靠输血维持生命,3~4 周输血1 次,随年龄增长日益明显。患有该症的患儿往往活不过5岁。
从上图2可以看出,我国β-地中海贫血基因治疗仅包括3项,且尚未完成临床试验入组招募。同时,部分企业和医院合作开展了相关了研究,取得初步进展。据北京五加和企业官方报道,第一例采用基因治疗重型β地中海贫血的患者,于2017年12月在广州南方医院顺利完成细胞产品回输;2020年7月,上海邦耀生物宣布,与中南大学湘雅医院合作首次通过CRISPR基因编辑技术治疗β0/β0型重度地贫的临床试验取得初步成效。
对照全球进展,我们在药物研发上面仍需加速。2019年5月,蓝鸟生物(bluebird)的基因疗法Zynteglo获得欧盟有条件批准,用于适合造血干细胞(HSC)移植但没有人类白细胞抗原(HLA)匹配的HSC供体、年龄在12岁以上、非β0/β0基因型输血依赖性β地中海贫血(TDT)患者的治疗,治疗价格约为180万美元。
四、展望未来:如何发展我国基因治疗
展望未来,综述里着重提到,目前基因治疗的难点——载体。除了载体对治疗的有效性之外,载体致癌的安全性控制也是研发重点。
目前的载体包括病毒载体(慢病毒载体、逆转录病毒载体、腺病毒载体和AAV等)和非病毒载体(质纳米颗粒和转座子等)。在我国,载体研发集中于非病毒载体,这类载体包括诸多挑战,例如如内吞作用、内体逃逸和细胞内释放等。
如何发展我国基因治疗?结合综述,有以下三点可以去推动:
■ 加强市场教育
作为一种新兴疗法,基因治疗正在改变制药行业的面貌,但它还远未成熟,即应允许有探索的时间和空间。当发生严重不良事件时,公众的态度以及引导可能直接决定了基因疗法的命运。
■ 推动投资环境
在数字技术支持下,虽然改善了此前“10年10亿美金”现状,但对于临床试验的长周期高投入仍有作充分准备,将对产业化起着关键作用。例如,2018年8月,博雅辑因完成亿元Pre-B轮融资,11月在广州南沙启动基因编辑治疗基地,实现GMP量产,准备针对β地中海贫血的地中海贫血。再例如,广州瑞风生物在联想之星资本支持下,利用CRISPR等技术进行地中海贫血等罕见病基因疗法开发等。
■ 更“简化”的监管
更好地协调不同的监管规范并简化特别条件下规范,可能有利于我国基因治疗的研究和产业发展。
参考资料:
1. Dawei Wang,Kang Wang,Yujia Cai,An overview of development in gene therapeutics in China, Nature,2020