TACTIC-2是一项I/II期多中心开放标签试验,旨在评估 TAC01-HER2在HER2阳性转移、晚期、不可切除实体瘤(如乳腺癌、胃癌和许多其他癌症)患者中的安全性、耐受性和疗效。该试验正在美国德州大学MD安德森癌症中心、丹娜法伯癌症中心和芝加哥大学站点积极招募,计划招收约70名受试者。
在这项试验中,Triumvira还将研究一些生物标记物,包括TAC-T细胞是否保留记忆表型、长期的T细胞持续性(这两种情况已在动物研究中被证实)以及细胞因子释放谱。
基于加拿大麦克马斯特大学Jonathan Bramson博士和Christopher Helsen博士的科研成果,总部位于美国得克萨斯州的Triumvira在2015年成立,并于2020年8月完成5500万美元的A轮融资。公司基础技术是T细胞抗原偶联剂(T-cell Antigen Coupler,TAC)。

Triumvira总裁兼首席执行官Paul Lammers, MD(左);公司创始人兼主席Triumvira科学顾问(右)。(来源:Triumvira官网)
TAC是一种嵌合分子,包含多个蛋白质结构域,可将肿瘤靶向能力与T细胞自身的激活机制相结合。一旦整合到患者T细胞中,其一个结构域便会与肿瘤特异性靶点结合,促进对肿瘤细胞的识别;而第二个结构域则会将TAC分子与内源性天然T细胞受体(TCR)连接起来。TAC分子通过CD4共受体结构域锚定在膜中,这为TAC增加了共受体功能。基于这些功能的结合,TAC能引导TCR信号通路的自然激活和T细胞介导的肿瘤细胞杀伤。
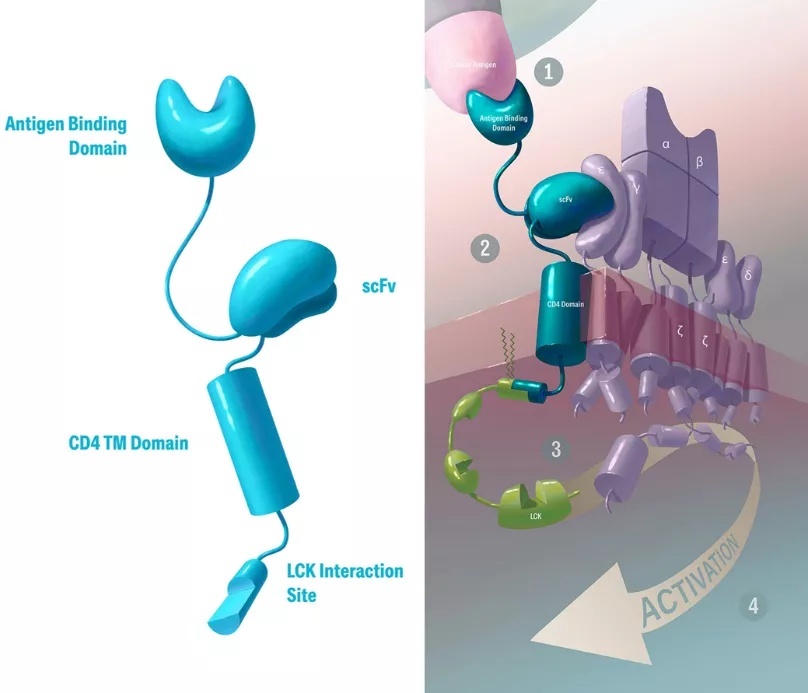
来源:Triumvira官网
由于TAC本身没有任何信号转导能力,T细胞的激活仅由内源性天然TCR介导。因此,TAC在充分利用T细胞抗癌潜力的同时,保留了细胞的自然控制和安全机制。
Lammers解释说:“我们的TAC技术是一种多结构域嵌合分子,它直接与T细胞受体作用,帮助T细胞识别和攻击癌细胞。使用细胞内共受体序列作为其结构域之一是Triumvira完全独有的。该策略旨在保留T细胞的天然控制和内部反馈机制,与具有激活域或共刺激域的CAR-T细胞不同,TAC-T细胞不表现出强直信号。”
这种导致T细胞过早衰竭的强直信号使实体瘤变得难以攻击。Triumvira认为,它的TAC-T细胞能够为深处实体肿瘤的浸润提供更强大的持久性,从而最终突破这些更具韧性的癌症。
此外,与TCR-T细胞相比,TAC-T细胞具有更广泛的适用性,可以攻击不同的肿瘤抗原或不同类型的肿瘤。
因为,TCR方法限于与主要组织相容性复合体(MHC)的蛋白质结合,而MHC在癌细胞中的表达水平通常较低,因此使用这种方法具有很多限制。TAC-T细胞则没有这样的限制,因此具有先进的抗原靶向性。再加上增加的T细胞的持久性、可控的细胞因子释放以及正常的免疫突触建立,Triumvira的目标是战胜各种血液系统恶性肿瘤和实体瘤。
Lammers补充说:“在临床前模型中,TAC技术已被证明优于CAR-T和TCR方法(疗效和安全性)。”

Triumvira产品管线
Triumvira的首个项目针对HER2,目前公司正在探索针对与多发性骨髓瘤密切相关的BCMA、在结直肠癌和胃癌中过表达的GUCY2C,以及在胃癌和非小细胞肺癌中过表达的Claudin 18.2等抗原的其他TAC。此外,针对Glypican-3(GPC3)的TAC研究也在进行中,GPC3是肝细胞癌(HCC)中经常升高的一种新靶点。Triumvira 正在积极筹备,在未来两三年内申报4到5个IND。当然,除了首要使命——改善癌症患者的生活,公司还设想将TAC技术应用于自身免疫和抗感染疾病领域。
考虑到当前细胞治疗制造和递送过程的成本和效率低下是将这些有希望的治疗方法带给患者的最大障碍。为了克服这些挑战,Triumvira正在采用同种异体方法,使用γδ T细胞。这类细胞也具有天生的肿瘤和病原体杀伤能力。与传统的αβ T细胞相比,γδ T细胞能识别其目标抗原而不受MHC限制,并介导抗肿瘤反应,而不会引起移植物抗宿主病。
此外,Triumvira于2020年3月与Lonza进行了合作,以利用细胞和基因治疗制造业领导者在工艺开发方面的专业知识以及可放大的自动化Cocoon®平台来实施其自体项目。Lammers博士表示:“利用创新技术自动化制造流程可以提高一致性。制造工艺一旦商业化,便可以即时使用,这对于实体瘤患者而言是至关重要”。
总的来说,关于本次首例患者给药,Lammers博士表示:“尽管CAR-T细胞疗法在治疗血液系统恶性肿瘤方面取得了进展,但实体瘤中仍有大量患者需要安全有效的疗法。这一临床试验的启动是Triumvira的一个重要里程碑,也是为我们的TAC技术建立临床概念验证的机会。”