
这些研究结果显示,PDE9(phosphodiesterase type 9)酶的一种化学抑制剂刺激细胞燃烧更多的脂肪。这发生在雄性小鼠和性激素通过切除卵巢而减少从而模拟绝经期的雌性小鼠身上。众所周知,绝经后的女性腰部周围肥胖的风险增加,并有心血管和代谢疾病的风险。抑制PDE9并没有在拥有卵巢的雌性小鼠身上引起这些变化,因此雌激素状态在这项研究中很重要。
论文通讯作者、约翰霍普金斯大学医学院心脏病学教授David Kass博士说,“目前,还没有一种药丸被证明对治疗严重肥胖有效,然而这类肥胖是一个全球性的健康问题,它增加了许多其他疾病的风险。使我们的发现令人兴奋的是,我们发现了一种激活小鼠脂肪燃烧的口服药物,以减少肥胖和脂肪在肝脏和心脏等器官中的堆积,从而导致疾病。”
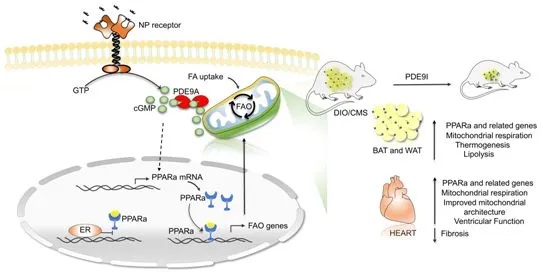
这项新的研究是在Kass实验室在2015年报告的一项研究工作--首次发现PDE9酶存在于心脏中,并促进高血压引发的心脏病--之后进行的。阻断PDE9会增加一种称为环状GMP(cGMP)的小分子的数量,而cGMP接着会控制整个身体的细胞功能的许多方面。PDE9与另一种叫做PDE5的蛋白存在同源关系;PDE5也控制cGMP的产生,并被诸如伟哥(Viagra)之类的药物所阻断。PDE9的抑制剂是实验性的,所以目前还没有药物名称。
基于这些结果,这些作者猜测抑制PDE9可能会改善心血管代谢综合征(cardiometabolic syndrome, CMS),这是一种常见的疾病组合,包括高血压、高血糖、胆固醇和甘油三酯,以及身体脂肪过多,尤其是腰部周围。
虽然PDE9抑制剂仍然是实验性的,但它已经被几家制药公司开发出来,并在人类身上测试,用于治疗阿尔茨海默病和镰状细胞病等疾病。这项新的研究使用的是辉瑞公司制造的PDE9抑制剂:PF-04447943,该抑制剂首先被用于阿尔茨海默病的测试,但最终放弃了这一用途。
在两项报告的临床试验之间,超过100名受试者接受了这种药物,并且发现它的耐受性良好,没有严重的不良副作用。目前,一种不同的PDE9抑制剂正在进行治疗人类心力衰竭的测试。
为了测试PDE9抑制剂对肥胖和CMS的影响,研究人员让小鼠接受高脂肪饮食,导致其体重翻倍,四个月后出现高血脂和糖尿病。一组雌性小鼠的卵巢被手术切除,而且其中的大多数小鼠的心脏也被施加了压应力(pressure stress),以更好地模拟CMS。然后,这些小鼠被指定在接下来的六到八周内口服PDE9抑制剂(药物组)或安慰剂(安慰剂组)。
在没有卵巢的雌性小鼠(绝经后的模型)中,药物组和安慰剂组的体重变化中位数差异为-27.5%,在雄性为小鼠中,这一差异为-19.5%。这两组的瘦体重(lean body mass,也称为去脂体重)都没有改变,日常食物摄入或身体活动也没有改变。PDE9抑制剂降低了血液中的胆固醇和甘油三酯,并将肝脏中的脂肪减少到在正常饮食的小鼠中发现的水平。心脏在PDE9抑制剂的作用下也得到了改善,与安慰剂相比,射血分数(衡量每次收缩时离开心脏的血液百分比)相对提高了7%~15%,心脏质量(肥大)增加减少了70%。心脏质量(heart mass)的增加是异常心脏应激的证据。然而,PDE9抑制剂降低了这一点,表明心脏遭受的应激减少了。
揭示PDE9抑制剂减肥机制,图片来自Journal of Clinical Investigation, 2021, doi:10.1172/JCI148798
研究人员发现,PDE9抑制剂通过激活一种称为PPARa的脂肪代谢主调节因子而产生这些效果。通过刺激PPARa,控制将脂肪摄入细胞中并将它们用作燃料的蛋白的基因水平广泛增加。当PPARa在细胞或整个动物中被阻断时,PDE9抑制对肥胖和脂肪燃烧的影响也会消失。他们发现雌激素通常发挥着PPARa对女性脂肪调节的这一作用,但当它的水平像绝经后那样下降时,PPARa对调节脂肪变得更加重要,因此PDE9抑制的效果更大。
论文第一作者、约翰霍普金斯大学医学院助理研究员Sumita Mishra注意到,“这种实验性药物(PF-04447943)对拥有卵巢的雌性小鼠没有好处,这一发现表明这些性激素,特别是雌激素,已经达到了抑制PDE9刺激脂肪燃烧的效果。绝经期降低了性激素水平,它们对脂肪代谢的控制随之转移到受到PDE9调控的PPARa蛋白上,所以这时进行药物治疗是有效的。”
Kass说,“我并不是建议长时间坐着或躺着,吃药物减肥,但我猜测结合饮食和运动,PDE9抑制的效果可能会更大。下一步将是在人体中进行测试,看看PDE9抑制剂是否在男性和绝经后女性中产生类似的效果。PDE9抑制剂已经在人类身上进行了研究,所以临床肥胖研究应该不会太远了。”
参考资料:
Sumita Mishra et al. Inhibition of phosphodiesterase type 9 reduces obesity and cardiometabolic syndrome in mice. Journal of Clinical Investigation, 2021, doi:10.1172/JCI148798.