定义
高级别浆液性癌(HGSC)由一种显示浆液性分化的高级别上皮性肿瘤。
ICD-0编码
8461/3 高级别浆液性癌
ICD-11编码
2C73.03 卵巢高级别浆液性腺癌
相关命名
无
亚型
无
部位
卵巢
流行病学
患者呈现广泛的年龄范围(平均年龄约65岁)。HGSC是最常见的卵巢癌(约占70%),在白种人群具有较高发病率。年龄>60岁、乳腺癌/卵巢癌家族史和不育是风险因素,而多产次、哺乳、口服避孕药、月经初潮晚和绝经早是保护因素。
病因学
未知
发病机制
肿瘤起源于输卵管型上皮,常发生在输卵管伞,少见于卵巢表面或上皮包含囊肿内。几乎每个肿瘤都发现有害的TP53突变(伴有非同义突变,比移码突变和缺失更常见)和复杂的高水平拷贝数异常。同源重组缺陷型肿瘤缺失了修复双股DNA断裂的能力。大约15%的疾病是由于BRCA1或BRCA2胚系突变,少数(约1%)与中等通透性基因(如RAD51C/D和BRIP1)的胚系突变有关。更少肿瘤含有BRCA1或BRCA2体系突变、BRCA1甲基化以及其他同源性重组基因的基因组异常。其他患者可有未知原因的发生卵巢癌的家族倾向。
临床特征
临床症状无特异性,与盆腹腔器官受累有关。大约80%患者表现为FIGO III或IV期疾病。>90%患者血清CA-125升高(>35单位/ml),但无特异性。
大体检查
肿瘤通常是双侧发生,体积巨大,外生性,呈实性和乳头状生长,并有充满液体的囊肿。实性区域呈灰白色,常有广泛坏死。输卵管通常埋陷于卵巢肿瘤内,肉眼无法辨认。有时发现少数肿瘤位于输卵管伞端。常有广泛的卵巢外累犯。
组织病理学
HGSC通常呈实性、乳头状、迷宫样(有裂隙样腔隙)、腺样和筛状区域。核大,显著异型性(核大小差异>3倍),核分裂象活跃,常>5个/mm2,等同于0.55mm直径视野和0.24mm2面积中>12个/10HPF,包括非典型核分裂象。常见坏死和多核细胞。少见形态包括微囊结构伴囊腔内和胞质内黏液、胞质透明和(非常罕见)印戒细胞样;滤泡模式;以及梭形细胞。低倍镜下,少数肿瘤结构类似浆液性交界性肿瘤,没有明显的破坏性浸润,但应根据核级别诊断为HGSC。

图1.20 高级别浆液性癌。乳头状结构,显著核多形性,核分裂活跃。
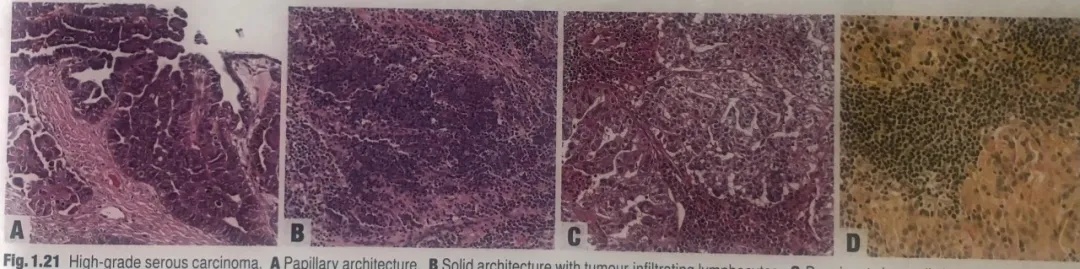
图1.21高级别浆液性癌。A乳头状结构。B实性结构伴肿瘤浸润性淋巴细胞。C明显的透明细胞改变,类似透明细胞癌。这种发现通常是局灶的,其免疫组化表达谱与传统的HGSC相同。D部分肿瘤细胞含有胞质内黏液(黏液卡红染色)
同源重组缺陷型肿瘤常呈现变异型结构,包括SET(实性solid、子宫内膜癌样endometial-like和移行细胞癌样transitional的英文首字母缩写)。也可见微乳头和巨细胞。这些肿瘤常显示地图样坏死和显著的淋巴细胞浸润。
约90%肿瘤呈WT1弥漫核阳性,约95显示p53异常表达模式(突变型),表现为80%以上细胞核弥漫强阳性、失表达(内对照正常)或罕见弥漫胞质染色而核弱阳性。CK7、CA125和PAX8通常阳性,ER通常表达。≥50%肿瘤细胞呈p16弥漫强阳性。CK20、CEA、HNF1β和napsin A通常阴性。通常仍表达PTEN和ARID1A。
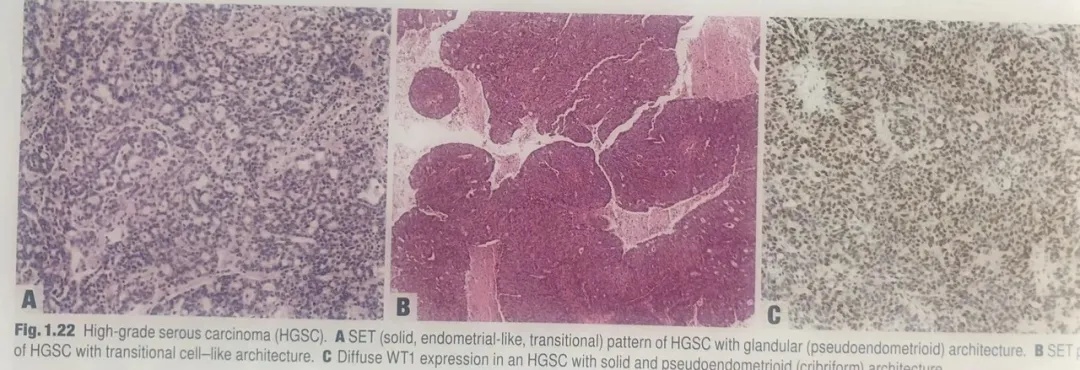
图1.22高级别浆液性癌(HGSC)。A为HGSC的SET模式伴腺样(假子宫内膜样)结构。B为SET模式伴移行细胞癌样结构。C实性和假子宫内膜样(筛状)结构,弥漫性表达WT1
图1.23高级别浆液性癌。A突变型p53表达,几乎所有(>80%)肿瘤细胞核呈强阳性。B突变型p53表达,肿瘤细胞失表达,注意良性细胞仍保留表达,作为内对照。C突变型p53表达,不同程度的胞质显色,这是最少见的HGSC表达模式。
细胞学
HGSC特征是多形性肿瘤细胞形成三维细胞簇,有大量大小不一的胞质空泡,显著的核异型性,核质比变化大,高核质比最常见于分离的细胞。细胞可形成乳头、无特征的细胞团或单个散在。常见砂粒体。当形态学特征不确定时,异常p53表达(过表达或失表达)和大片p16(CDKN2A)表达可能有助于区分LGSC,但要注意并非所有HGSC都是p16弥漫强阳性。
图1.24高级别浆液性癌。多形性肿瘤细胞含有胞质大空泡,核异型性明显。
诊断性分子病理学
无临床相关性
最低诊断标准
必需:浆液性肿瘤伴实性(有裂隙样腔隙)、乳头、腺体或筛状结构;核大、显著异型性(核大小差异>3倍);核分裂高度活跃
满意(在一些选择性病例中):WT1阳性,p53突变型表达
分期
根据国际癌症控制联盟(Union for International Cancar Control,UICC)TNM分类进行HGSC分期。
预后和预测
超过95%患者就诊时已有卵巢外疾病。5年中位生存率介于15%-55%之间,分期和肿瘤减灭程度是主要预后因素。尽管约有65%患者对首次化疗敏感,大多数病例复发,临床特征为铂类敏感(可接受;治疗后>6个月复发)或铂类耐受(不可接受,治疗后<6个月复发)。与proficient(?)肿瘤相比,同源重组缺陷型肿瘤对铂类更敏感,BRCA1/2胚系突变患者的预后更好。最近的治疗方法注重化疗后维持治疗。多聚(ADP-核糖)聚合酶(PARP)抑制剂靶向DNA损伤的修复,使用它作为维持治疗,显著改善了BRCA1/2携带者和同源重组缺陷携带者的无进展生存期,为胚系突变患者提供最大程序的临床获益。体细胞检测同源重组缺陷或其基因组标记物可确定PARP治疗的适应症。大概10-15%患者长期生存,但这种例外治疗反应仍然无法用分子学解释。
临床、放射、血清学和组织学方法都可以评估化疗反应。广泛采用病理学化疗反应评分(CRS),因为它与总生存和无进展生存具有良好相关性。CRS 1对应于无反应或轻微反应,CRS 2可识别肿瘤反应但有残留肿瘤,CRS 3完全或几乎完全缓解。