胸痛、气喘乏力、心力衰竭?
贫血、蛋白尿、肾功异常?
腰背痛、骨质疏松、腰椎骨折?
咋眼看去,不就是常见的老年病嘛?如果我告诉你,这复杂多样的表现症状可能是一种血液病,你会不会大吃一惊呢?且从笔者发现一例高球蛋白血症说起。
案例经过
生化“侦察兵”拦截
某心血管科患者,男,66岁,入院加急生化检查,总蛋白(TP)和球蛋白(GLB)触犯生化组设置的报警规则(TP>90g/L,GLB>50g/L),其数据如图1所示:
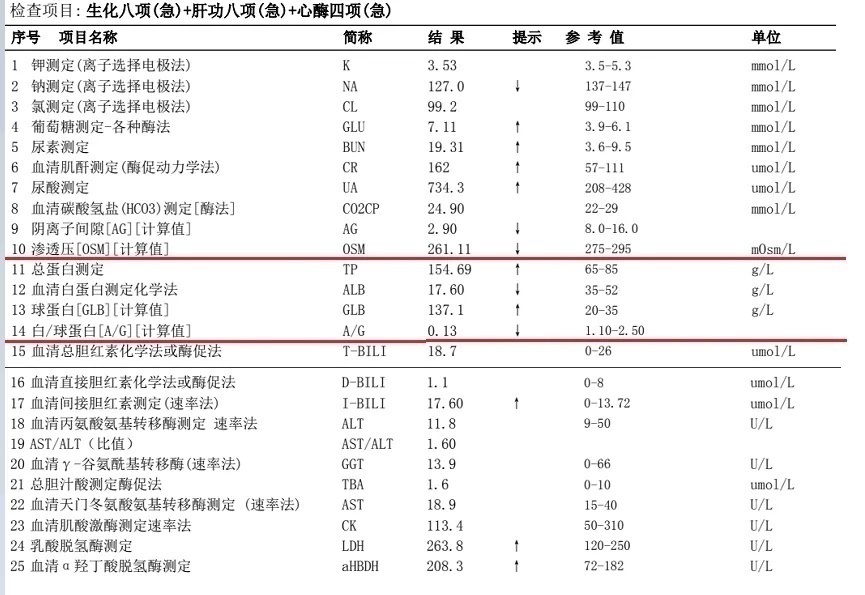
图1 生化检测报告
从检查报告来看,该患者肾功能受损,蛋白水平异常增高,A/G倒置,心肌酶谱稍高。标本状态、血清分离比例正常,在确保当天仪器状态和质控水平正常后对标本进行复查,结果相差不大,生化反应曲线正常,未受其它因素干扰。
一个心血管的患者,球蛋白这么高,难道是肝脏疾病?肾脏疾病?多发性骨髓瘤?带着疑问,查看患者其他报告:
1.血细胞计数:
WBC 6.75×109/L、RBC 2.33×1012/L、Hb 72g/L、PLT 221×109/L,未触犯血液组报警规则。报告仅提示患者有贫血,马上让有经验的同事帮忙推片染色镜检,显微镜下发现部分红细胞呈缗钱状排列,其他无异常(图2~4所示)。
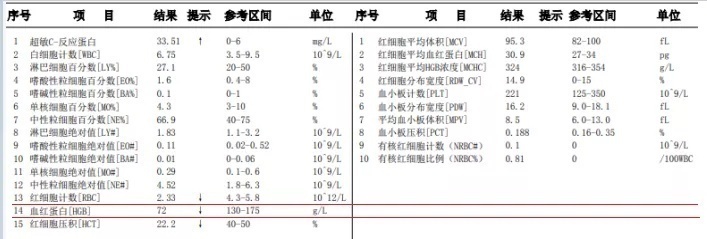
图2 血常规报告
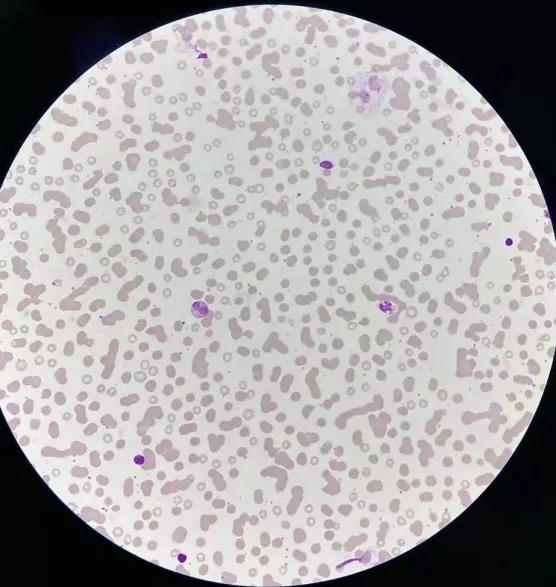
图3(低倍)
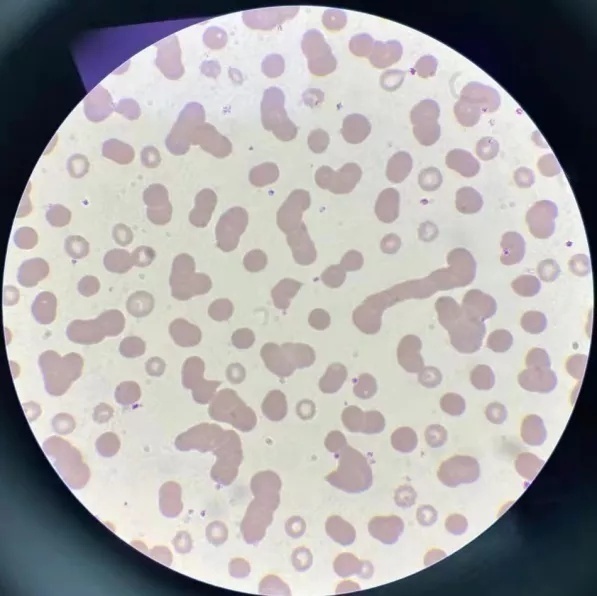
图4(高倍)
2.免疫球蛋白结果:IgG 81.42g/L,增高幅度较大
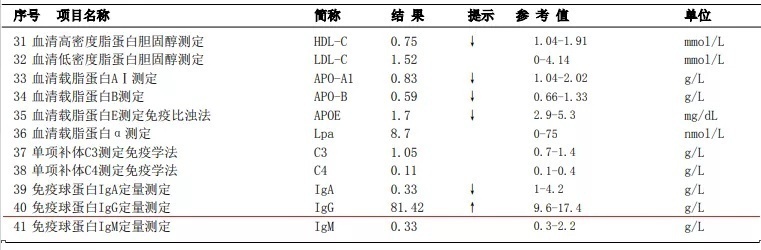
图5 免疫球蛋白结果
3.凝血结果:PT、TT偏高,D二聚体较高,未检测FDP,不排除受干扰。
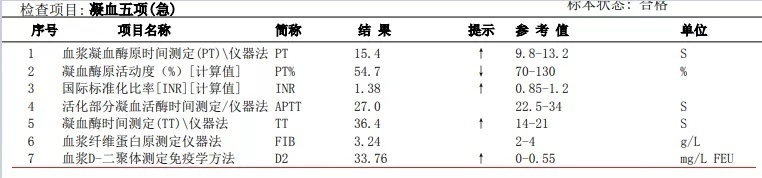
图6 凝血结果
4.肾脏早期损害的检查:各项肾脏早期指标升高,提示肾小球功能出现问题。
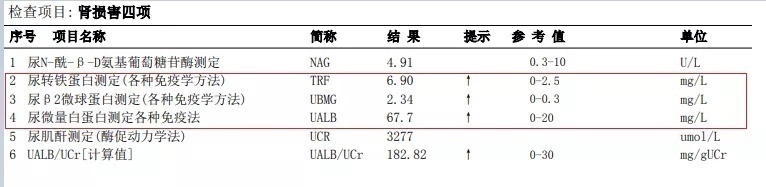
图7 肾损害项目结果
5.其它检查结果:钙、镁正常、磷偏高1.84mmol/L(参考范围:0.85-1.51mmol/L),尿常规正常,MYO和PCT偏高。
仔细查阅患者电子病历,患者男,66岁,因“气喘乏力1周余,加重伴呛咳3天”入住广东省第二中医院心血管内科治疗,除高血压外无其他慢性疾病史,无家族遗传病史及传染病史,于1周前不慎撞到柜子后开始出现气喘、乏力、纳差、二便失禁,刚开始未予以重视,3天前出现饮水呛咳、气喘乏力加重,门诊医生拟“心力衰竭?”收治入院。
体温37.4℃,脉搏86次/分,呼吸25次/分,血压155/85mmHg,胸痛、背痛、腰痛。1个月前外院检查腰椎DR示腰椎、骨盆退行性变,骨质疏松伴有病理性骨折(胸骨、T6、T11、L2、L3椎体,左侧第4肋骨),脑部CT提示脑出血。
这时候,多发性骨髓瘤的猜测就更坚定了。记得以前进修时老师提过,如果将多发性骨髓瘤的患者标本加入纯水中,由于M蛋白的存在可能会出现混浊现象,于是做了一个小试验,将怀疑MM患者血清与正常健康体检者的血清各2滴分别加入纯水观察(图8)。

图8
笔者惊讶地发现,怀疑MM患者的标本确实明显要比正常人的标本浊度增加。这可能是由于水的pH为7,而血清中各种蛋白的等电点(pI)大都低于7,且白蛋白<α1球蛋白<α2球蛋白<β球蛋白<γ球蛋白,因此比起其他蛋白来说γ球蛋白的等电点更接近7,而在等电点时,该蛋白在溶液中的溶解度最小,容易发生聚集析出沉淀。
另外,也和M蛋白的聚合程度有关,部分浓度比较高的M蛋白在特定条件下产生沉淀会引起浊度增加,减少血清标本的可溶性,亦会干扰多个临床常规检测项目比色,引起假阴性的结果。
案例分析
我们知道血液中存在着各种各样的蛋白质,按照蛋白质构象粗略分为白蛋白及球蛋白,正常情况下球蛋白大部分由肝脏合成,γ球蛋白由浆细胞分泌,其主要成分为免疫球蛋白,球蛋白异常为肝脏疾病及免疫系统受损的间接表现,甚至是某些疾病的早期诊断指标。
高球蛋白血症常见临床疾病包括急慢性感染、恶性肿瘤、自身免疫性疾病、慢性肝脏疾病及浆细胞病(多发性骨髓瘤为主)。[1]本例患者除了肾功能受损,明显异常的是TP、GLB,结合转氨酶指标正常,排除球蛋白来源于肝脏的可能。
综合患者为老年男性,有贫血、感染、免疫球蛋白异常增高、肾功能不全、骨质破坏、血涂片部分红细胞呈缗钱状排列,我们马上电话临床,建议医生考虑血液相关疾病,不排除多发性骨髓瘤的可能,需完善免疫固定电泳和骨髓形态学等进一步检查。
多发性骨髓瘤最终确诊
随后临床对患者进行了系列的贫血指标病因筛查、骨碱性磷酸酶测定、降钙素测定,除RET 3.22%,ESR 101mm/h,其他均无明显异常。
而血清蛋白电泳(图9)显示在r-球蛋白区出现M-蛋白区带,血清免疫固定电泳(图10)发现IgG-κ异常单克隆条带,尿液免疫固定电泳(图11)IgG-κ伴κ游离轻链型。通过进一步骨髓形态学检查证实(图12),这是一例多发性骨髓瘤患者。
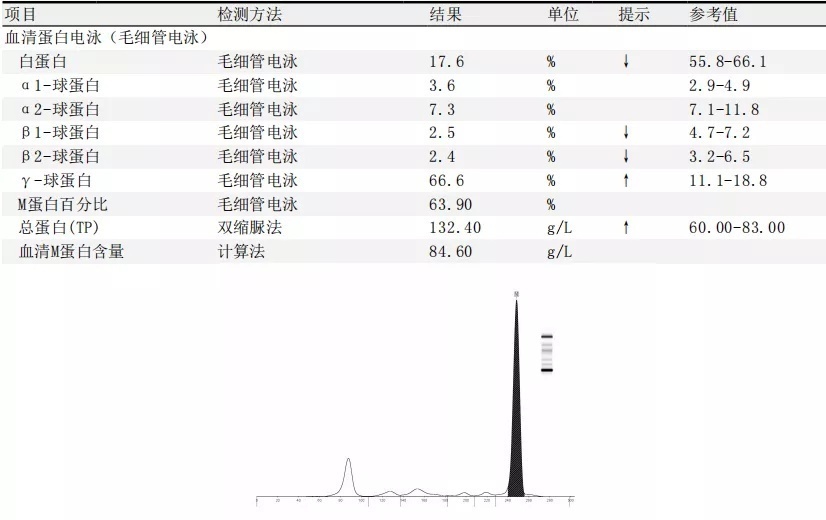
图9 血清蛋白电泳
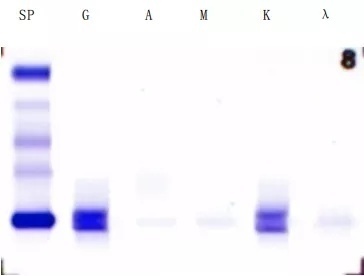
图10 血清免疫固定电泳
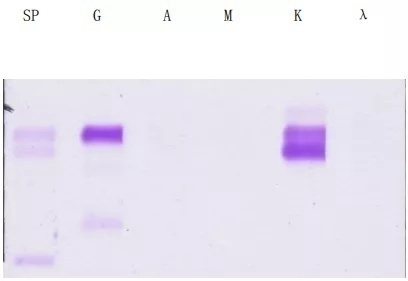
图11 尿液免疫固定电泳
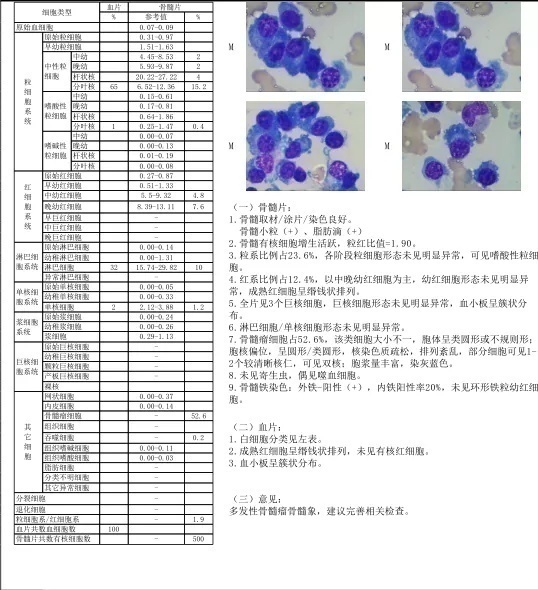
图12 骨髓形态学报告
案例总结
多发性骨髓瘤(MM)是很多国家血液系统第二大常见恶性肿瘤,根据《中国多发性骨髓瘤诊治指南》2020年修订版,依照M蛋白类型可将MM分为:IgG型、IgA型、IgD型、IgM型、IgE型、轻链型、双克隆型以及不分泌型。进一步可根据M蛋白的轻链型别分为κ型和λ型。[2]
我国MM发病率没有很准确的统计学数字,从目前诊治情况看,发病率较前增加,M蛋白类型方面IgG和IgA型相对多见,本例患者即是IgG-κ型。
大部分MM患者发病呈慢性过程,早期可无症状,但随着病情发展,浆细胞大量增殖并分泌M-蛋白,患者开始出现各种症状和体征。MM的临床表现非常广泛,有研究表明超过50%多发性骨髓瘤容易被误诊,误诊疾病中以运动系统和泌尿系统疾病居多(如误诊骨质疏松症、腰椎间盘突出症、骨折、骨继发恶性肿瘤、肾炎、肾功能不全、肾病综合征等)[3]。
本例患者以气喘乏力在心内科就诊,临床也常见以骨痛在骨科就诊,或以急慢性肾衰竭在肾内科就诊,也有因神经系统为首发症状就诊,因此多学科合作具有重要意义。
当中老年人出现以下症状,就要格外注意:
1.骨痛、骨折、血钙升高:MM患者由于骨髓克隆性浆细胞恶性增殖和广泛浸润并合成大量M-蛋白,从而引起广泛性溶骨性骨质破坏、出现骨痛甚至病理性骨折和高钙血症。
2.长期贫血伴高球蛋白血症:由于浆细胞异常增殖,瘤细胞浸润骨髓,正常造血细胞增殖被抑制常会出现不同程度的贫血、血小板减少等。异常增多的免疫球蛋白使血浆黏度增高,红细胞聚集性增大,全血黏度增加和红细胞沉降率增快,从而导致高粘滞综合征。
3.肾功能损害:大量的Ig轻链可在肾小管被重吸收而大量沉积在肾小管上皮细胞,造成肾功能受损,出现蛋白尿、血尿、管型尿,约半数人尿中出现本-周蛋白,血清肌酐、尿素增高。
4.反复感染、出血、淀粉样变等症状:患者可因正常免疫球蛋白含量减少、免疫功能缺陷等导致反复感染。浆细胞分泌的单克隆性免疫球蛋白与血浆中某些凝血因子形成复合物或粘附在血小板表面而阻碍了正常的止血和凝血过程,患者可表现为皮肤黏膜甚至组织器官出血。
MM合并心肌淀粉样变性发病率约为10%,其中轻链型占比约为20%,免疫球蛋白的轻链与多糖的复合物形成的淀粉样物质沉积于心肌为该病的发病机制,临床上主要表现为:心律失常、低血压、心力衰竭、胸闷呼吸困难、心脏标记物异常等,常伴预后不良,死亡率高。
MM特殊实验室检查包括两个方面:
一、从形态学和病理学角度,骨髓穿刺涂片或或组织病理检查通过辨别细胞形态、免疫组化染色甚至骨髓细胞流式细胞术分析找到肿瘤性浆细胞;
二、从生化学角度,对患者血清和尿液蛋白进行电泳和免疫固定电泳以及血清游离轻链检测得到肿瘤细胞分泌的克隆性免疫球蛋白存在的证据,后者对于非分泌型MM是必要的。
由于MM对患者骨质存在不同程度的破坏,常见的表现为骨质疏松、溶骨性改变和病理性骨折,临床可以通过骨骼X线、CT和MRI等影像学检查加以查证。但由于许多疾病都存在骨质破坏,是非特异性的表现,因此,寻找肿瘤性浆细胞和克隆性免疫球蛋白才是诊断MM的关键。
作为检验人,每天工作得忙忙碌碌,审核的标本成百上千,在这其中,总有一些特殊的、百思不得其解的异常数据,我们不能放过任何一个细节,不能目光狭隘,医院分专科,但疾病却并非分科室而生。
在常规的检查中发挥检验医师的作用,收集患者资料,调研患者症状和其他检查,抽丝剥茧分析检验数字背后的可能病因,综合分析,排查各种可能导致异常的检测结果,为临床医生提供建设性意见,将临床思路与检验报告相结合。我们要拓宽思维,增长见识,丰富知识,才能成为一名合格的医生,减少误诊遗漏,让患者得到及时的医治。
专家点评
多发性骨髓瘤起病缓慢,早期无明显症状,容易被误诊。MM的临床表现多样,主要有贫血、骨痛、肾功能不全、感染、出血、神经症状、高钙血症等,抓住多发性骨髓瘤的不同病因、症状及时治疗非常重要。这就需要我们有足够的经验和能力,合理地设置信息系统拦截规则,规范复核要求,加强与临床的沟通,让患者早诊早治,改善预后。
点评专家:广东省第二中医院检验科主任/主任技师谭俊青
参考文献
[1]苏延军,胡小军,李改英,等.高球蛋白血症268例鉴别诊断[J].中国现代医药杂志,2017,19(5):58-60
[2]中国医师协会血液科医师分会,中华医学会血液学分会,中国医师协会多发性骨髓瘤专业委员会.中国多发性骨髓瘤诊治指南(2020年修订).中华内科杂志,2020,59(5):341-346.
[3]曾敏,羊裔明.误诊疾病数据库2004-2013年单病种误诊文献研究:多发性骨髓瘤[J].临床误诊误治,2017,30(1):31-35