
图片来源:https://doi.org/10.1080/19
肠道微生物群与宿主生理学和病理生理学密切相关。例如,在无菌结直肠癌(CRC)模型中的研究显示,与传统饲养条件下的相应动物相比,肠道炎症和肿瘤预后较低。粪便微生物群移植成功地用于治疗艰难梭菌的反复感染,并为炎症性肠道疾病、功能性胃肠疾病和肥胖症患者提供了好处。
人们对定义改变肠道微生物区系以预防和治疗疾病的干预措施越来越感兴趣。流行病学研究表明,结直肠癌与绿色蔬菜和纤维的摄入量低有关,而深叶蔬菜的摄入量则与风险降低有关。然而,关于这些饮食摄入量如何影响肠道微生物区系、宿主转录和胃肠道致病机制之间的串扰,我们知之甚少。
菠菜(Spi)是一种深色绿叶蔬菜,具有较高的叶绿素含量和多种生物活性。作者采用大肠腺瘤性息肉病(APC)突变大鼠模型来检测饮食SPI的抗癌效果。大鼠结肠息肉病(Pirc)模型模拟人类家族性腺瘤性息肉病患者的疾病进展,包括结肠和小肠自发肿瘤的发展。遗传模型避免了以前饮食SPI使用的致癌物治疗的需要,而腺瘤性息肉的负担有助于通过结肠镜检查进行肿瘤抑制的时间追踪。
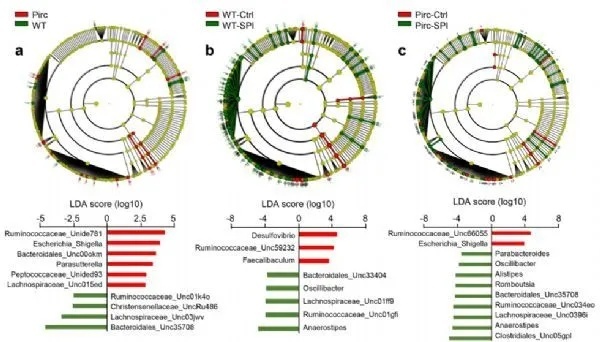
饮食菠菜重塑了微生物群及其预测的元基因组
图片来源:https://doi.org/10.1080/19490976.2021.1972756
在本研究中作者观察到食用大豆分离蛋白具有显著的抗肿瘤效果,尽管存在apc突变的遗传背景,β-catenin蛋白在结肠息肉中仍然高度过表达。随后,人们探索了肠道微生物组与脂肪酸代谢、三羧酸(Tca)循环和癌症途径中的多组体变化有关的机制。
总之,作者首次在APC-突变型Pirc模型中提供了饮食SPI显著抗癌效果的证据。在排除了去调控的β-catenin作为主要机制靶点后,随后的工作发现,在喂养Spi的大鼠肠道微生物群发生了显著的重塑,同时宿主转录和RNAmiRNA网络也发生了变化。代谢组学分析证实了预测的亚油酸和丁酸代谢、TCA循环和癌症途径的变化。
虽然丁酸代谢可能与肠道微生物群的α多样性增加有关,但在饮食SPI治疗的大鼠结肠肿瘤中,检测到多种已知抗炎和促凋亡机制的SPI衍生的亚油酸中间体水平增加。最近的一份报告证实了15-LOX-1/13(S)-HODE机制,使用条件基因敲除和结直肠癌过表达的小鼠模型,这暗示了LRP5-SNX17的相互作用。未来的实验将寻求从本文报道的工作中证实更多的机制线索,包括膳食纤维方面和集成多组学确定的其他靶点。
参考文献
Ying-Shiuan Chen et al. Dietary spinach reshapes the gut microbiome in an Apc-mutant genetic background: mechanistic insights from integrated multi-omics. Gut Microbes. Jan-Dec 2021;13(1):1972756. doi: 10.1080/19490976.2021.1972756.