2022年1月18日,暨南大学张灏团队在Molecular Cancer(IF=27)在线发表题为“A signature of saliva-derived exosomal small RNAs as predicting biomarker for esophageal carcinoma: a multicenter prospective study”的研究论文。

食管鳞状细胞癌 (ESCC) 的癌症发病率在全球排名第七,在癌症死亡率方面排名第六。 患者在诊断时通常处于淋巴结转移的优势阶段,这导致 5 年生存率约为 20%。为了最大限度地提高治愈性手术切除的机会,预计早期发现和诊断 ESCC 很重要。目前,缺乏适合检测早期ESCC的生物标志物。此外,30%~40%的患者在为治愈目的手术切除后会出现局部复发。辅助放疗和化疗对 ESCC 很重要,但它们的临床益处存在争议。也没有生物标志物可以预测 ESCC 辅助治疗的益处。因此,对于这种恶性肿瘤,迫切需要早期发现患者并进行更精确的分层以指导辅助治疗。
内窥镜活检活检是侵入性的,影像学检查作为 ESCC 的筛查方式不敏感。 细胞海绵或经鼻内窥镜检查等微创技术具有成本和不适障碍,无法广泛接受作为 ESCC 的筛查方法。最近,液体活检已被广泛研究用于非侵入性癌症检测,它主要基于源自癌症的三种核心生物材料:循环肿瘤细胞(CTC)、循环肿瘤DNA(ctDNA)和外泌体。 尽管有潜力,但使用 ctDNA 和 CTC 作为液体活检方法有一些局限性。
鉴于总游离 DNA 中 ctDNA 的比例通常很少,通常 < 0.01%,检测灵敏度是一个严重的问题,特别是对于早期癌症检测。 此外,由于极其稀有、脆弱和致癌/表型异质性,CTC 转化为临床实践受到其分离挑战的限制。相比之下,外泌体是一种细胞外囊泡,含有蛋白质、DNA 和 RNA,代表了它们分泌细胞的许多特征。外泌体由各种类型的细胞分泌,反映了与肿瘤相关的异质生物学变化。
外泌体包含许多类型的小 RNA,例如 miRNA、piwi 相互作用 RNA (piRNA)、小核仁 RNA (snoRNA)、tRNA 衍生的小 RNA (tsRNA) 和其他未识别的小 RNA。尽管 miRNA 是外泌体中研究待剩最多的一类小 RNA 生物标志吊消这物,但其他源自外泌体的小 RNA 正候拆池在成为新的富含癌症的诊断和预后生物标志物。
tsRNA(也称为 tRNA 衍生片段 (tRF))最初被认为是降解产物,是由前体或成熟 tRNA生成的新型小非编码 RNA (sncRNA)。 tsRNA 以核酸酶(血管生成素、RNY1、Dicer)依赖性方式产生,以响应诸如氨基酸饥饿、氧化应激和缺氧等胁迫。由于肿瘤微环境的特点是缺氧和营养缺乏,因此很容易将 tsRNA 与癌症混为一谈。最近的研究发现 tsRNA 在各种类型的癌症中失调 。然而,基于 tsRNA 的液体活检潜力的探索仍处于早期阶段。
与需要采血获取液体活检样本的 ctDNA 和 CTC 相比,外泌体几乎存在于所有体液中,例如血液、唾液、尿液和脑脊液,拓宽了液体活检样本来源的选择范围。基于唾液外泌体的嵌合 RNA 和 mRNA 检测,作为一种非侵入性液体活检方法,用于诊断和监测疾病的进展。
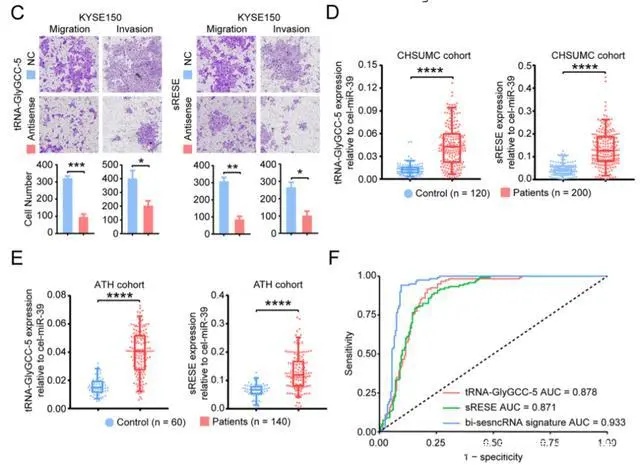
ESCC患者唾液外泌体中富含癌症的sncRNA的鉴定(图源自Molecular Cancer )
该研究通过对从食管鳞状细胞癌 (ESCC)患者 (n = 3) 和健康对照 (n = 3) 获得的唾液外泌体进行 RNA 测序鉴定出富含癌症的小 RNA,并在发现队列 (n = 66) 中进一步验证。该研究发现 tsRNA (tRNA-GlyGCC-5) 和以前未记录的小 RNA 在 ESCC 患者、ESCC 组织和 ESCC 细胞的唾液外泌体中特异性富集。 由这些小 RNA 组成的双特征能够以高灵敏度 (90.50%) 和特异性 (94.20%) 将 ESCC 患者与对照组区分开来。
根据预后双特征风险评分 (RSP),高 RSP 患者比那些低 RSP 的总生存期 (OS) (HR 4.95, 95%CI 2.90–8.46) 和无进展生存期 (PFS) (HR 3.69, 95%CI 2.24–6.10) 都短。此外, 辅助治疗仅对 RSP 高的患者改善了 OS(HR 0.47, 95%CI 0.29-0.77)和 PFS(HR 0.36, 95%CI 0.21-0.62)。 这些发现在训练和验证队列中都是一致的。
总之,基于 tsRNA 的特征不仅具有诊断和预后的潜力,而且可以作为术前生物标志物来选择将从辅助治疗中受益的患者。