面对这一现状,唯有进行肿瘤早筛,在肿瘤发生发展的源头,将其扼杀,才能逆转这个局面。
肿瘤早筛,国家一再强调,并发布的一系列文件,也表明了国家治理癌症医疗问题的决心。
2019年7月,《健康中国行动(2019-2030)》中特别提出了“癌症防治行动”。

设定了硬性的行动目标:到2022年和2030年,总体癌症5年生存率分别不低于43.3%和46.6%;癌症防治核心知识知晓率分别不低于70%和80%;高发地区重点癌种早诊率达到55%及以上并持续提高;基本实现癌症高危人群定期参加防癌体检。
同年9月,国家卫生健康委等10部门联合制定了《健康中国行动——癌症防治实施方案(2019—2022年)》。
到2022年,癌症防治体系进一步完善,危险因素综合防控取得阶段性进展,癌症筛查、早诊早治和规范诊疗水平显著提升,癌症发病率、死亡率上升趋势得到遏制,总体癌症5年生存率比2015年提高3个百分点,患者疾病负担得到有效控制。
2021年5月24日,国务院办公厅印发《深化医药卫生体制改革2021年重点工作任务》,提出:扩大高发癌症筛查覆盖范围,启动县级癌症筛查和早诊早治中心建设试点。
肿瘤筛查尤为重要。
目前,肿瘤早筛对大部分的老百姓来说还是相对陌生。由于我国14亿的人口基数,致使医疗资源显得很是匮乏,同时由于传统的癌症筛查方法的局限性,例如血清学肿瘤标志物准确性低,假阳性率、假阴性率高;内镜检查作为一个侵入性的检查方式,受检者依从性低;B超、CT等影像学检查普及度不高等一系列问题,导致我国的肿瘤筛查现状并不理想,急切地需要一种新的肿瘤筛查手段,弥补空白。

随着分子生物学的高速发展以及在临床的应用越来越广泛,以及液态活检技术的不断发展,液态活检应用于肿瘤早筛成为当下最具潜力的早筛技术路径。
液体活检指通过对血液样品等非固体生物组织的采集,检测生物标志物,进而对全身进行肿瘤分析。目前液体活检针对的生物标志物可以分为三类:
1.血液中完整的细胞,即循环肿瘤细胞(CTC);
2.收集由肿瘤细胞释放的外泌体(EV);
3.分析游离的肿瘤 DNA 或 RNA,如循环肿瘤 DNA(ctDNA)、循环无细胞 RNA(cfRNA)、miRNA 等。
固体与液体活检样品中分析物的比较

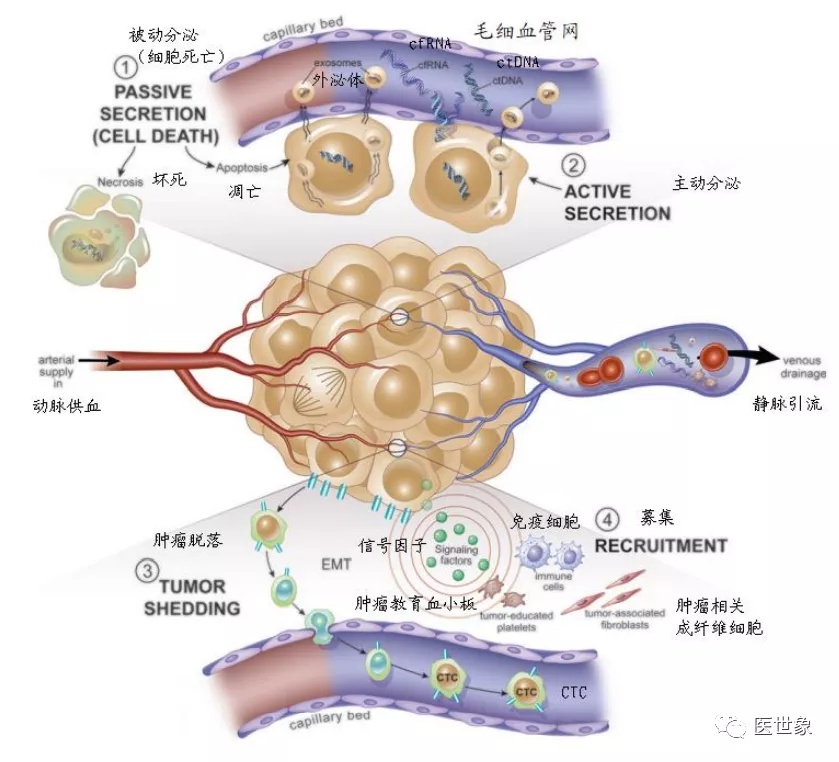
从肿瘤发生与转移机制看,肿瘤细胞通过被动分泌(坏死或凋亡)与主动分泌释放外泌体及 ctDNA、cfRNA 等进入血液,可在超早期探测到肿瘤信号。而 CTC 细胞的形成主要在肿瘤转移时,肿瘤上皮细胞通过 EMT 效应转化为具有间质表型的细胞,粘附能力减弱,失去与基底膜的连接并从原发灶肿瘤上脱落从而进入到血液系统。因此 CTC 在早期肿瘤中含量较低,即使在肿瘤转移患者中每百毫升全血中也仅有 1-10 个 CTCs, 富集难度较大。同时由于 ctDNA 甲基化能够追溯肿瘤组织来源等临床价值,我们认为以 ctDNA 为代表的液体活检技术在肿瘤早筛领域有较大发展潜力。
肿瘤转移与血液中的肿瘤成分
ctDNA 基因突变检测:信号放大是痛点,已知突变检测 PCR 足以胜任
为了追踪肿瘤,需要区别 ctDNA 与正常 cfDNA 的区别,目前主要通过基因突变、甲基化修饰状态、拷贝数异常,以及核小体站位等作为区分依据。基因突变是造成癌症的根本原因之一,因此也是最先遭到检测分析锁定的对象。
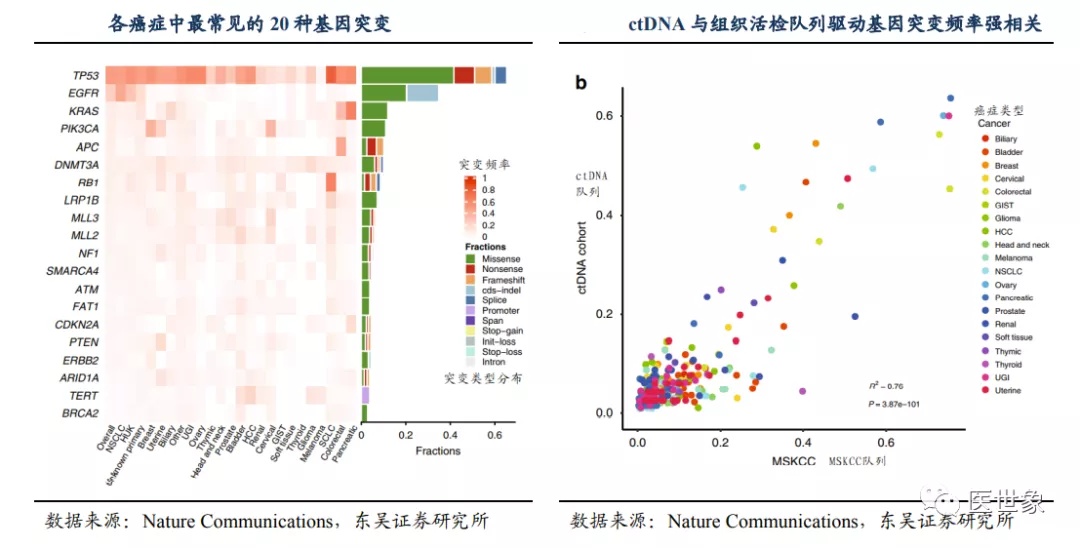
根据 Nature Communications 文献数据,非小细胞肺癌中 EGFR(44.2%)突变,小细胞肺癌的 RB1(63.4%)突变, 结直肠癌中的 APC(44.4%),KRAS(33.8%)和 PIK3CA(11.2%)突变均显示了利用 ctDNA 突变进行肿瘤筛查的潜力,ctDNA 突变也被证明与组织活检检测到的驱动基因频率有强相关关系。
然而以 ctDNA 突变检测进行肿瘤早筛的主要难度在于灵敏度难以提高。首先血液中 ctDNA 的丰度较低,10ml 全血平均包含 4ml 血浆,6000GE。
根据 Nature Genetics 数据,以 VAF(变异等位基因频率)识别肿瘤信号检测检测灵敏度极限为 0.01%(即能够 检测 12000 个拷贝中的一个 DNA 片段)。而血液中 ctDNA 的含量与肿瘤大小有关,尽管可以通过近处取样(如采集粪便检测结直肠癌脱落标志物)增加 ctDNA 浓度,但无技术突破或有效测序降噪手段的情况下,ctDNA 特有标记将淹没在噪声中,一般情况下(采集血液)对直径 12.5mm(重量 1g)以下的肿瘤难以识别。同时由于 ctDNA 高度碎片化,半衰期短,且 ctDNA 含量在不同人间差异很大,因此需极好的富集及测序深度才能有效捕捉基因突变相关的早期癌症信号。

此外,利用 ctDNA 突变进行肿瘤早筛的技术挑战还包括克隆性造血与早期癌症的定位。
根据 Nature Communications 文献对 12377 名患者的 14972 份外周血样本 cfDNA 检测结果,14%的样本检测出克隆性造血(CH)变异,涉及 15 个突变基因(最常见的 是 DNMT3A、TP53 和 TET2),而黑色素瘤、膀胱癌、子宫癌和前列腺癌发生 CH 变异的频率大于20%。同时 CH 变异频率随年龄增加而升高,为 ctDNA 突变的识别造成障碍。

测序方面,对 ctDNA 的测序技术主要包括 PCR 与 NGS 法,BEAMing 法、ARMSPCR 与 Tam-Seq 等则是在 PCR 与 NGS 技术的基础上进行改进。当前对单癌种的检测往往只需要测定部分靶点的已知基因突变,此时 PCR 由于检测时间短、成本低、灵敏度高等优点足以胜任。NGS 法的优势主要在于高通量,可对未知序列进行测序,但成本相对较高,在未来识别未知基因突变上或更具优势。
ctDNA 检测方法(部分)对比

ctDNA 甲基化测序:最具潜力的液体活检技术路径
DNA 的甲基化是一种表观调控修饰,可以在不改变碱基序列的情况下参与调控蛋白质的合成。这主要是由于 CpG 岛的超甲基化改变了 DNA 区域构象,影响蛋白与 DNA 的相互作用从而影响转录效率,而启动子区域的甲基化会使基因表达沉默。与 ctDNA 特 定位点突变的模式相比,癌症中 ctDNA 的甲基化往往发生在数以千计的 CpG 位点,更易探测和评估。同时根据张鹍教授于2017年发表在 Nature Genetics 上的研究,甲基化模式可反映特定癌症的表观遗传起源,并被用于揭示未知原发性癌症的起源组织。因此 ctDNA 甲基化的检测在灵敏度和定位癌症位置两方面均强 于对基因突变的检测。
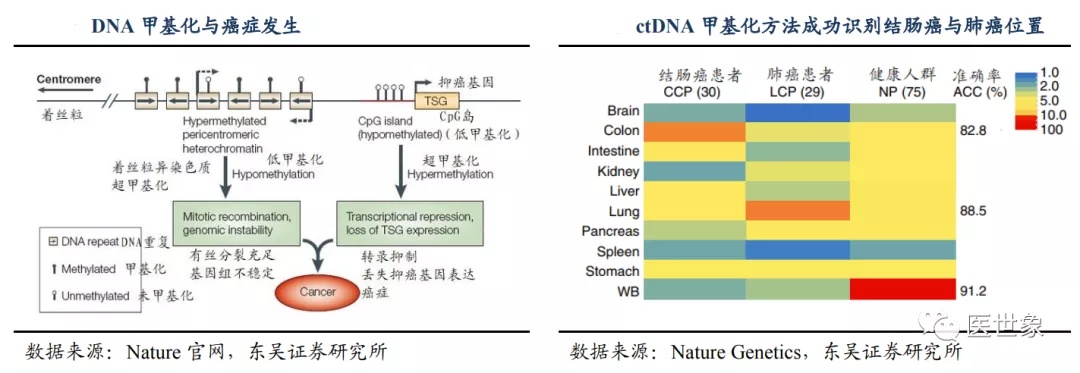
传统的 DNA 甲基化测序其一是通过甲基化 DNA 结合蛋白(MBD)或甲基化抗体 (MeDIP)进行捕获测序以获得全基因组内 100-1000bp 分辨率的甲基化信号,然而无法 获得单碱基分辨率信号;其二简化基因组甲基化测序(RRBS)利用限制性内切酶富集 CpG 区域可获得部分基因组单碱基分辨率信号;全基因组甲基化测序(WGBS)则利用 亚硫酸氢盐(BS)将非甲基化的 C 转为 U,之后通过简单地测序即可获得甲基化修饰信 号。尽管 WGBS 兼顾了全基因组测序和获取单碱基信号的优点,但 BS 转化属于极端环境,对 DNA 损伤极高,易出现单双链混合、缺刻、缺口损伤等现象,可造成约 90%的 DNA 模板丢失,因此其建库起始量很高,且有效数据量低(为获得 30X 的测序深度需 高达 230Gb 左右的测序数据量,冗余率过半)。尽管后续通过一系列引物设计、建库优 化等方法可对 WGBS 测序进行优化,但应用于临床仍有较大缺陷。
考虑 ctDNA 甲基化标志物的验证技术手段,目前一方面甲基化检测在靶向捕获技术进步的推动下在靶向测序平台(PCR 与杂交捕获)已实现较好的商业化,另一方面针对甲基化的 BS-free 测序技术正逐步实现突破。我们认为甲基化检测的靶标选择、测序技术等仍是癌症早筛企业的壁垒之一,未来技术突破有望提升测序准确度,更精准识别甲基化信号。
甲基化测序方法对比


从当前已商业化基于 DNA 甲基化生物标志物的产品看,部分甲基化靶点如 SEPT9、 MGMT 等已成为明星靶点。如 FDA 批准 Epigenomics 公司的结直肠癌早筛产品 EpiproColon 后,国内 NMPA 随后批准了博尔诚(引进 Epigenomics 专利)、为真生物、透景生命的 SEPT9 甲基化检测试剂盒,均为辅助诊断用途。韩国 Genomictree 公司适用于结直肠癌,检测 SDC2 甲基化的产品 EarlyTect 于 2014 年获 KFDA 批准后,国内康立明生物、艾德生物的 SDC2 甲基化检测也随后获 NMPA 批准(同样为辅助诊断用途)。由此可见,当前海外已获批靶点的甲基化检测产品国内较易获证并推动商业化,但单靶点的甲基化检测产品较难获批早筛用途,而仅作为金标准检查的辅助诊断手段。
随着ctDNA 甲基化测序等液态活检技术的不断发展与完善,作为一种无创无痛的筛查方式,在未来肿瘤早筛领域极具竞争力。