近日,《柳叶刀-胃肠病学和肝脏病学》最新发表一项来自西奈山伊坎医学院(Icahn School of Medicine at Mount Sinai)团队的2期临床试验结果。研究显示,新辅助免疫治疗cemiplimab(PD-1抑制剂)在近1/3患者中诱导了肿瘤细胞在术前大面积(≥50%)死亡。
论文指出,这是“迄今报道的肝细胞癌PD-1抑制剂单药新辅助治疗的最大临床试验。”研究中观察到的病理缓解支持设计更大规模的试验,来进一步确定最佳治疗持续时间并明确临床获益。

截图来源:The Lancet Gastroenterology & Hepatology
既往研究已经初步显示,新辅助免疫治疗在多种肿瘤类型中能够诱导病理缓解,并可能降低肝细胞癌术后复发风险。新辅助免疫疗法不仅可以杀死肿瘤,还有望通过持久的免疫反应,杀死手术难以完全消除的微小癌细胞,而这些微小癌细胞可能导致未来的癌症复发或转移。因此,这项研究旨在评估cemiplimab新辅助治疗在可切除肝细胞癌患者中的临床活性。
这是一项单臂、开放标签的2期试验,共纳入了21例可切除肝细胞癌(Ib、II和IIIb期)患者,患者接受cemiplimab新辅助治疗(350 mg静脉输注,每3周接受两个周期治疗),随后进行手术切除,术后再进行cemiplimab辅助治疗(350 mg静脉注射,每3周接受8个周期)。
研究主要终点是病理检查的显著肿瘤坏死(tumour necrosis,定义为切除肿瘤>70%坏死)。次要终点包括手术延迟、总体缓解率、CD8+ T细胞密度的变化和不良事件。在接受至少一剂cemiplimab并完成手术切除的所有患者中分析肿瘤坏死和缓解率;在意向治疗人群中分析安全性和其他终点。患者接受了治疗前活检,并在整个治疗过程中接受了血液采集。
所有入组患者都接受了cemiplimab新辅助治疗,20例患者成功切除。其中4例(20%)患者在新辅助免疫治疗后观察到明显的肿瘤坏死,包括3例(15%)为完全坏死;7例(35%)患者肿瘤坏死率≥50%。根据影像学结果,3例(15%)患者达到部分缓解(肿瘤体积缩小≥30%),所有其他患者的疾病保持稳定。
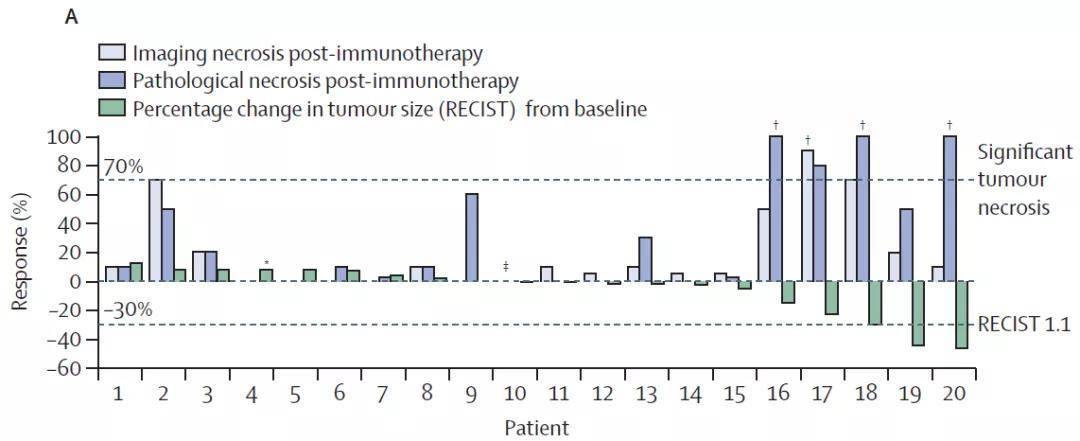
▲20例手术患者的缓解(影像学)和肿瘤坏死(影像学和病理学)情况
肿瘤坏死的MRI评估结果与病理学评估结果密切相关,但坏死评估结果(无论病理学或影像学)与肿瘤缓解结果只有中度相关性,并且这种相关性并不显著。这种差异提示,每个指标在量化肿瘤体积减少方面都有各自的局限性。
免疫组化分析显示,坏死率≥50%的患者,往往在治疗前的免疫细胞数量就更多,治疗后免疫浸润密度和肿瘤浸润淋巴细胞进一步增加,包括CD8+ T细胞浸润显著增加。换言之,治疗前免疫系统已在对抗癌症的患者往往对免疫疗法有更多的反应,且免疫系统会被免疫疗法进一步激活。
治疗安全性可接受。没有一名患者因不良事件而取消手术。新辅助免疫疗法的一大可预见潜在障碍是因毒性风险而导致根治性手术延迟,这项试验中,只有1例患者出现肺炎,导致手术延迟2周。
20名(95%)患者在新辅助治疗期间出现任何级别的治疗相关不良事件。最常见的任何级别不良事件是天冬氨酸氨基转移酶升高(4例)、血肌酸磷酸激酶升高(3例)、便秘(3例)和疲劳(3例)。
7例患者出现3级不良事件,包括血肌酸磷酸激酶升高(2例)和低白蛋白血症(1例)。
未观察到4级或5级事件。
图片来源:123RF
“我们认为患者在手术前接受免疫治疗更好,因为人们在转移前更健康,他们的免疫系统处于更好的状态,可以更好抵抗癌症。结合许多其他类型肿瘤的新辅助免疫治疗试验结果,这项研究支持了有必要评估围手术期免疫治疗策略以降低复发风险。”研究通讯作者、西奈山伊坎医学院Thomas Marron教授表示,“未来更大规模的试验将有助于确定新辅助免疫疗法的实用性、安全性和生存获益。”
同期评论文章也指出,未来研究应考虑肝癌新辅助免疫治疗最合适的药物组合、最佳治疗持续时间以及基于危险因素分层的后续术后治疗。早期疾病活动性指标(如肿瘤坏死)与复发风险持久降低之间的相关性仍有待证实。
[1] Thomas U Marron, et al., (2022). Neoadjuvant cemiplimab for resectable hepatocellular carcinoma: a single-arm, open-label, phase 2 trial. The Lancet Gastroenterology & Hepatology, DOI: https://doi.org/10.1016/S2468-1253(21)00385-X
[2] Nicola Personeni, Lorenza Rimassa. (2022). Exploring novel avenues for neoadjuvant treatment of hepatocellular carcinoma. The Lancet Gastroenterology & Hepatology, DOI:https://doi.org/10.1016/S2468-1253(21)00462-3
[3] Immunotherapy before liver cancer surgery can kill tumor, and likely residual cancer cells. Retrieved January 24, 2022 from https://medicalxpress.com/news/2022-01-immunotherapy-liver-cancer-surgery-tumor.html