2024年7月10日,哈佛医学院陈正一及复旦大学舒易来等多团队合作在Science Translational Medicine在线发表题为“Targeted genome editing restores auditory function in adult mice with progressive hearing loss caused by a human microRNA mutation”的封面论文,该研究通过筛选不同的CRISPR系统,优化Cas9表达和sgRNA支架,开发了一种针对MIR96突变14C> a的基因组编辑疗法,以实现高效和特异性的突变编辑。
AAV将金黄色葡萄球菌Cas9的KKH变体(SaCas9-KKH)和sgRNA递送至症状前(3周龄)和症状期(6周龄)成年Mir9614C>A/+突变小鼠耳蜗可长期改善听力,且在幼龄时注射效果增强,没有AAV基因组整合的证据,表明体内基因组编辑策略具有良好的安全性。该研究开发了一个双AAV系统,包括AAV-sgmiR96-master,该系统携带sgRNA,可对抗所有已知的人类MIR96突变。由于小鼠和人类MIR96序列具有100%的同源性,该研究的方法和sgRNA的选择为长期听力恢复提供了高效和特异性的毛细胞编辑,为MIR96突变引起的DFNA50患者的治疗奠定了基础。
另外,2024年6月5日,复旦大学舒易来、李华伟、王武庆及哈佛大学陈正一共同通讯在Nature Medicine在线发表题为“Bilateral gene therapy in children with autosomal recessive deafness 9: single-arm trial results”的研究论文,该研究报告了一项单臂试验的中期分析,该试验调查了5例DFNB9患儿双耳治疗的安全性和有效性。主要终点是6周时的剂量限制性毒性,次要终点包括安全性(不良事件)和有效性(听觉功能和言语感知)。未发生剂量限制性毒性或严重不良事件。共发生36例不良事件。最常见的不良事件是淋巴细胞计数增加(36人中有6人)和胆固醇水平升高(36人中有6人)。所有患者双侧听力均恢复。所有患者在基线时右(左)耳听觉脑干平均反应阈值>95 dB (>95 dB),26周时右(左)耳听觉脑干平均反应阈值恢复为患者1的58 dB (58 dB),患者2的75 dB (85 dB),患者3的55 dB (50 dB), 13周时患者4的75 dB (78 dB)和患者5的63 dB (63 dB)。5例患者均恢复语音感知和声源定位能力。这些结果为双耳AAV基因治疗遗传性耳聋的安全性和有效性提供了初步的见解。该试验正在进行中,将进行更长时间的随访,以确认安全性和有效性的发现(点击阅读)。
2022年7月20日,复旦大学舒易来,李华伟及中国科学院脑科学与智能技术卓越创新中心杨辉共同通讯在Science Translational Medicine在线发表题为“Rescue of autosomal dominant hearing loss by in vivo delivery of mini dCas13X-derived RNA base editor”的研究论文,该研究在肌球蛋白 VI p.C442Y 杂合突变 (Myo6C442Y/+) 小鼠模型(该模型概括了人类显性遗传性耳聋的表型)中使用基于 Cas13 的 RNA 碱基编辑器评估了 RNA 校正疗法。该研究首先在培养细胞中筛选了几种基于 Cas13 的 RNA 碱基编辑器和靶向Myo6C442Y的引导 RNA (gRNA),发现基于迷你 dCas13X.1 的腺苷碱基编辑器 (mxABE)[由截短的 Cas13X.1 和作用于 RNA 2 脱氨酶结构域变体 (ADAR2ddE488Q) 的 RNA 编辑酶腺苷脱氨酶组成],表现出高效率的 A > G 转换和低频率的脱靶编辑。单个腺相关病毒 (AAV) 介导的 mxABE在耳蜗中的递送将突变的Myo6C442Y等位基因纠正为Myo6WT(Myo6C442Y/C442Y)等位基因,并导致Myo6C442Y/+小鼠的注射耳蜗中的Myo6WT等位基因增加。在向Myo6C442Y/+小鼠注射 AAV-mxABE-Myo6 后长达 3 个月,该治疗挽救了听觉功能,包括听觉脑干反应等。该研究还观察到与未处理的对照耳相比,处理后的毛细胞存活率增加,毛束形态退化减少。总之,该研究结果支持将RNA 编辑治疗策略用于半显性疾病和潜在的隐性疾病(点击阅读)。
2022年4月26日,复旦大学附属眼耳鼻喉科医院舒易来主任、李华伟教授和陈兵教授团队合作在生物医学领域期刊Molecular Therapy-Nucleic Acids在线发表了题为“Specific knockdown of Htra2 by CRISPR-CasRx prevents acquired sensorineural hearing loss in mice”的研究论文,该研究以基于CRISPR-CasRx 的RNA基因编辑前沿技术对药物引起的后天性感音神经性耳聋成功干预,为CasRx技术在临床的应用提供了重要理论依据(点击阅读)。
2024年1月24日,复旦大学舒易来等多团队合作在国际知名医学期刊Lancet在线发表题为“AAV1-hOTOF gene therapy for autosomal recessive deafness 9: a single-arm trial”的研究论文,这项单臂、单中心试验招募了患有严重至完全听力损失、证实有OTOF两个等位基因突变、未植入双侧耳蜗的儿童(1-18岁)。AAV1-hOTOF单次通过圆窗注入耳蜗。主要终点是注射后6周的剂量限制性毒性。该研究发现AAV1-hOTOF基因治疗是一种安全有效的治疗常染色体隐性耳聋的新方法(点击阅读)。
听力损失是一种影响全世界许多人的多因素疾病。单基因突变导致的听力损失占所有先天性感音神经性听力损失的50%以上,但目前还没有批准的药物或生物治疗可减缓或逆转遗传性耳聋。在这些耳聋基因中,microRNAs (miRNAs)是一种短[约20 - 24个核苷酸(nt)]的内源性非编码RNA],在蛋白质编码基因的表达调控中起着至关重要的作用,被认为是内耳发育的重要因素,也是正常听力所必需的。具体来说,MIR96 (microRNA-96;miR-96)已被确定为人类和小鼠非综合征进行性听力损失DFNA50(常染色体显性耳聋-50)的致病因素。人类MIR96种子区的突变是在人类孟德尔病中具有致病作用的miRNA成熟序列中发生点突变的第一个例子。
MIR96在内耳感觉细胞中特异性表达,并通过降低多个靶基因mRNA的表达,在耳蜗发育和听力维持中发挥关键作用。MIR96种子区的点突变导致人类家族中具有显性遗传模式的进行性听力损失。携带n -乙基-n -亚硝基脲(ENU)诱导突变Dmdo的小鼠表现出进行性听力损失的表型。纯合子Dmdo小鼠(Mir96Dmdo/Dmdo)和纯合子null小鼠(敲除Mir96和Mir183, Mir183/96dko/dko)完全失聪,毛细胞立体纤毛束在早期发育中出现异常,毛细胞数量减少,证明正常毛细胞发育需要Mir96。
相比之下,杂合子Mir96缺失小鼠(Mir183/96dko/+)保持正常听力,而杂合子Dmdo小鼠(Mir96Dmdo/+)出现早发性非综合征进行性听力损失,这表明听力损失表型是由新的靶基因获得而不是功能丧失引起的。在人类中,杂合子MIR96突变也会导致晚发性非综合征性进行性听力损失,这强烈表明由于突变而获得类似的功能。延迟性进行性听力损失为在小鼠模型中测试听力拯救干预措施提供了一个机会之窗,目标是应用于人类。
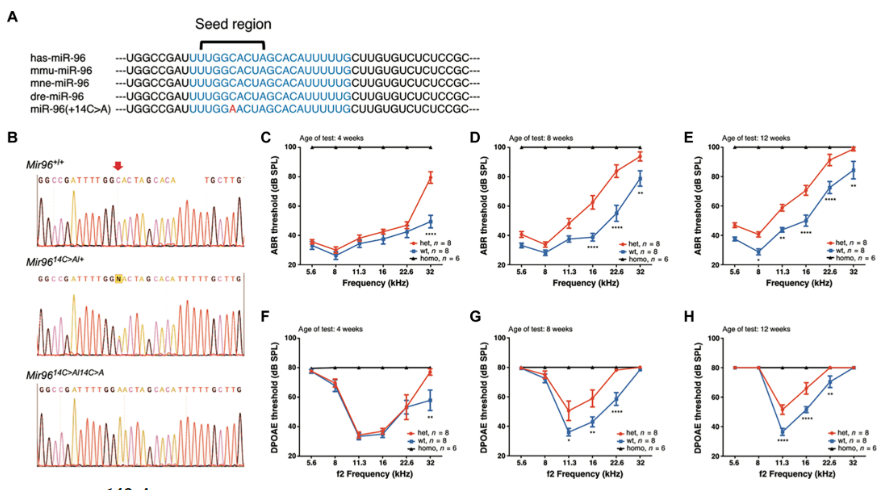
Mir9614C>A突变小鼠表现为早发性进行性听力损失(图源自Science Translational Medicine)
除了其显性遗传模式外,Mir96的过表达已被发现会导致耳蜗缺陷导致听力损失,这使得传统的异位Mir96表达基因治疗不适合。然而,针对Mir96显性突变的基因组编辑技术在治疗DFNA50方面具有很大的希望。在体内,通过脂质体核糖核蛋白(RNP)递送或腺相关病毒(AAV)介导递送Cas9核酸酶,已经证明在破坏多种听力损失疾病小鼠模型中的显性等位基因方面是有效的。内耳碱基编辑已被用于修复小鼠的Tmc1显性突变。在所有关于遗传性听力损失的编辑研究中,干预都是在耳蜗未成熟的新生小鼠中进行的。小鼠耳蜗经历了从新生儿到成年阶段的发育变化,包括大小、结构和功能的变化。这一区别凸显了需要评估成熟耳蜗基因组编辑治疗的有效性、安全性和时间窗口,以确定潜在临床应用干预的可行性。
该研究通过非同源DNA末端连接(NHEJ)对Mir96显性突变(Mir96tm3.1Wtsi,在本报告中称为Mir9614C>A;相当于人rs587776523, g.7:129414596G>T在GRCh38中)进行编辑,通过AAV介导的递送给听力损失的年轻成年小鼠。研究表明,AAV介导的编辑复合物的递送具有良好的耐受性,不会损害正常听力。该研究筛选了不同的编辑器,并确定了一个进行优化,从而在体外和体内进行高效和特异性的编辑。
该研究在听力损失发生之前和之后测试了干预措施,并建立了治疗导致持续听力保护的时间窗口。为了提高编辑策略的安全性,该研究建立了没有检测到AAV整合的剂量范围,并显示了在注射后12周结束的短暂SaCas9-KKH表达。由于人和小鼠Mir96在种子区100%共享序列,因此该研究开发了一种能够靶向多个Mir96突变的双AAV系统,为其潜在的推广和广泛应用提供了证据。总之,该研究确定了体内基因组编辑作为治疗成年动物基因突变引起的听力损失的可行方法的可行性。
参考消息:
https://www.science.org/doi/10.1126/scitranslmed.adn0689