2024年7月2日,兰州大学基础医学院魏虎来团队在期刊《Communications Biology》上发表了题为“RNA demethylase FTO participates in malignant progression of gastric cancer by regulating SP1-AURKB-ATM pathway”的研究论文。本研究重点介绍了FTO在GC发展中的作用,及其作为治疗靶点的潜力。团队结合生物信息学、临床数据、分子检测和功能实验,进行了全面的分析。
研究背景
胃癌 (GC) 对全球公共卫生构成了严峻的挑战。2020 年,全球有超过100万例新发病例和769,000例死亡。尽管胃癌的诊断和治疗取得了进展,但晚期GC的预后,仍然很差,远处转移患者的五年生存率低于5%。因此,确定新的治疗靶点,了解GC发展的分子机制,对于改善GC的早期诊断至关重要。
最近,RNA修饰在癌症中的功能,引起了越来越多的关注。RNA中最普遍的甲基化形式,是N6-甲基腺苷(m6A),其失调与包括GC在内的癌症发病机制有关。例如,去甲基化酶ALKBH5通过调节PKMYT1 m6A, 抑制胃癌的扩散。通过控制miR-30c-2-3p/AKT1S1轴,METTL14介导的circORC5的m6A改变,可防止胃癌的进展。脂肪量和肥胖相关蛋白(FTO)是第一个确定的m6去甲基化酶,可特异性去除RNA m6。FTO在许多癌症中进行表达,对癌症的发展有明显的影响。
特异性蛋白1(SP1)是一种转录因子,可在细胞增殖、分化和凋亡过程中,增强癌基因的转录。例如,USP39通过稳定和去泛素化SP1,来促进肝癌细胞的肿瘤发生。LncRNA THAP7-AS1通过使CUL4B进入细胞核,来促进肿瘤发生。它由SP1转录触发,并通过METTL3介导的m6A修饰转录后维持。AURKB 是有丝分裂和顺铂耐药的关键调节因子,可促进GC的生长、发育和转移。ATM基因的种系突变,导致毛细血管扩张综合征,表现为对恶性肿瘤的易感性增加。
本研究的目的,是检查FTO在GC增殖和转移中的作用。团队发现了一种涉及SP1、AURKB和ATM的新型信号通路,这是GC进展所必需的,为开发针对GC的治疗策略,提供了潜在的生物标志物。
研究进展
在GC中发现FTO的上调,并与不良预后相关
为探究FTO在GC发展中的作用,团队基于TCGA数据集和当地入组患者,分析FTO表达水平、患者生存率和各种临床病理参数。与正常组织相比,GC患者恶性组织中的FTO明显上调。为了验证这一结果,团队收集了20个临床样本,并评估了FTO表达水平。如IHC所揭示的那样,恶性组织中FTO的蛋白质和mRNA水平,都高于癌旁组织、蛋白质印迹和qPCR。此外,生存曲线显示,FTO表达水平升高的患者,在首次进展(FP)、总生存期(OS)和进展后生存期(PPS)方面,表现出明显较差的预后。FTO的上调,与晚期神经浸润、肿瘤大小和淋巴结转移(LNM)显著相关。FTO的mRNA水平和蛋白质在人GC细胞(HGC27、MKN-45、AGS和SGC-7901)中的表达,显著高于人正常胃粘膜上皮细胞(GES-1)。总之,以上数据表明,FTO表达上调,并与GC患者的肿瘤发生和不良临床结果相关。
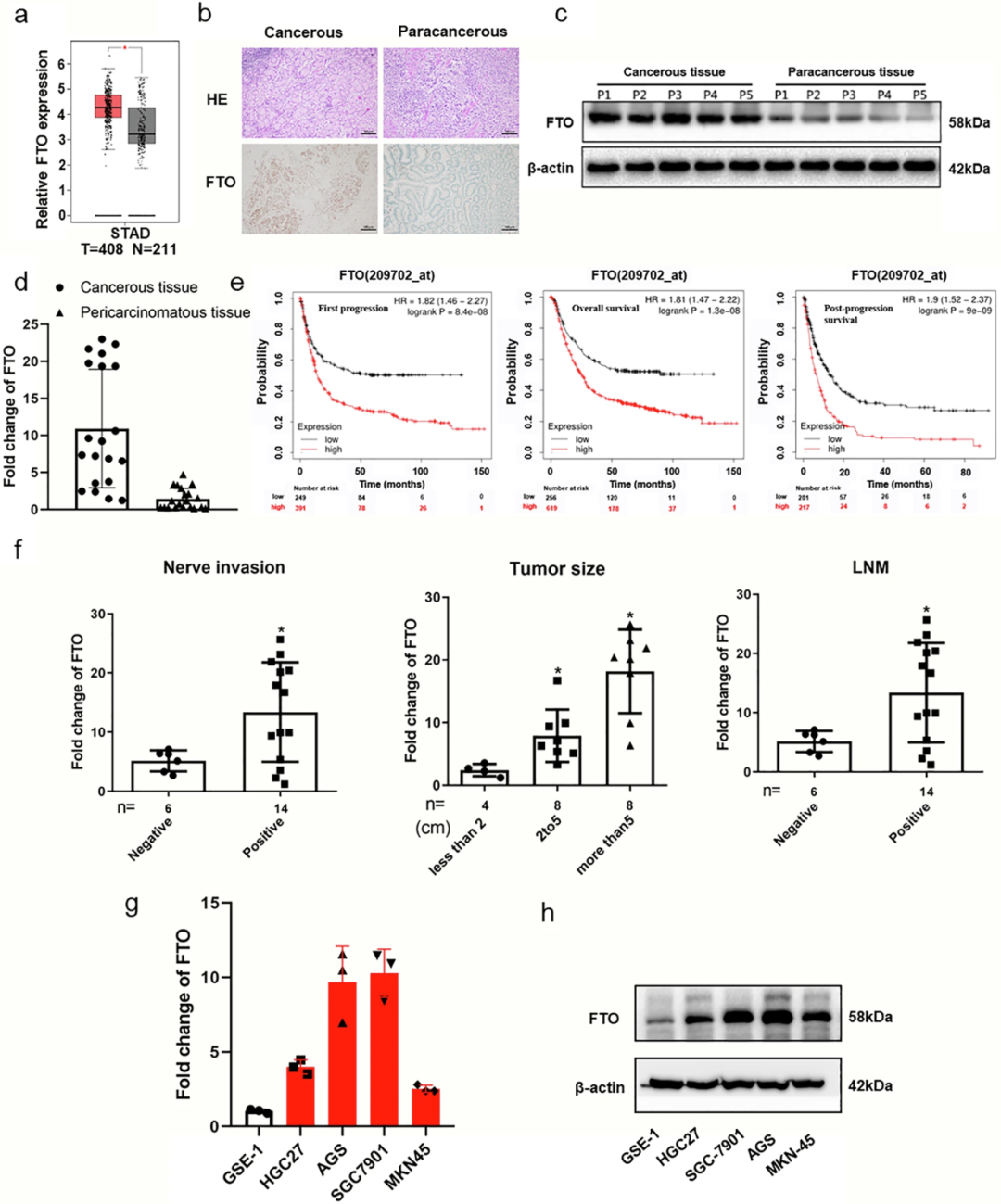
来自TCGA数据库的STAD(胃腺癌)和正常组织中的FTO表达水平。通过IHC(b)、Western blotting(c)和RT-qPCR(d)检测的GC患者癌性和癌副组织中的b–d FTO表达水平。e FTO表达水平高或低的STAD患者的首次进展(FP)、总生存期(OS)和进展后生存期(PPS)的Kaplan-Meier曲线。f 癌组织中FTO的上调与GC患者病理进展之间的关系。通过RT-qPCR(g)和Western blotting(h)法,测定人GC细胞系和正常胃黏膜上皮细胞中的GTO表达水平。 β-肌动蛋白用作RT-qPCR和蛋白质印迹测定的内部对照。*p < 0.05,**p < 0.01。
SP1是FTO的下游靶标,调节GC进展
已确认FTO可以促进GC细胞的增殖、迁移和侵入。团队通过使用FTO敲低和对照的AGS细胞中,使用m6A RNA甲基化测序,来研究m6A甲基化机制。团队发现,SP1的RNA甲基化水平,在FTO敲低组中显著增加。值得注意的是,转录组测序显示,SP1的转录水平在FTO敲低组中下调。实验数据表明,FTO通过去除其RNA甲基化,来控制SP1的表达。
FTO通过调节SP1-AURKB-ATM轴,来促进GC的发展
为了进一步确定FTO是否通过特异性调节SP1-AURKB-ATM轴,来促进GC的发育,团队首先研究了FTO敲低后GC细胞的生物学功能,无论是否伴有SP1/AURKB过表达(NC、sh-FTO、sh-FTO+oe SP1、sh-FTO+oe AURKB)。实验结果表明,存活率或增殖性、菌落形成、迁移和入侵AGS和SGC-7901细胞的能力,明显受到FTO敲低(sh-FTO)的抑制,而过表达SP1(sh-FTO+oe SP1)或AURKB(sh-FTO+oe AURKB),几乎可以完全挽救。此外,SP1或AURKB过表达,几乎恢复了FTO敲低抑制的ATM和P38,以及增加的P53磷酸化。这些发现表明,FTO对SP1/AURKB表达的上调,通过释放ATM/P38赋予的P53抑制作用,在驱动GC的发展中,发挥了重要作用。
此外,团队将稳定的AURKB敲低 (AURKB-KD),AGS细胞皮下注射到裸鼠体内,以制作异种移植GC模型。实验结果表明,AUKRB是GC的促进因子。为了研究SP1-AURKB-ATM轴在GC发育中的临床意义,团队利用SP1抑制剂普利卡霉素,抑制AGS和SGC细胞中SP1的表达,发现SP1明显抑制AURKB的表达水平,以及磷酸化ATM和P38的水平;同时,上调磷酸化P53的水平。总之,以上实验结果表明,SP1-AURKB-ATM轴在GC的发展中,起着关键作用。
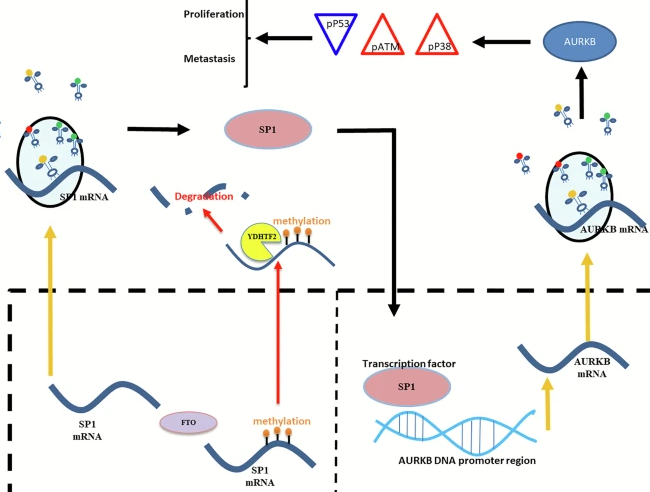
FTO-SP1-AURKB-ATM轴在气相色谱进展中的功能示意图。
研究结论
RNA表观遗传学,特别是可逆和动态的m6RNA甲基化,已成为癌变和癌症进展过程中,基因表达调控的关键方式。FTO在癌症研究中的重要性,正在增长,它能够调节RNA去甲基化。
本研究介绍了FTO在GC发展中的作用,及其作为治疗靶点的潜力。了解FTO在癌症进展中的作用,对于制定诊断和治疗GC的有效策略至关重要。因此,团队结合生物信息学、临床数据、分子检测和功能实验,进行了全面的分析。首先,团队发现,GC组织和细胞显著增加了FTO,这与晚期神经浸润、肿瘤大小和LNM,以及不良预后有关。这一结果与先前的研究一致,该研究将FTO与各种癌症联系起来,强调了FTO在GC中的临床相关性。RNA甲基化测序结果显示,在GC细胞中敲低FTO后,许多基因的甲基化状态,特别是与肿瘤转移和代谢相关的基因的甲基化状态,发生显著改变。表明FTO可能通过调节RNA甲基化的稳态和恶性进展或代谢相关基因的去甲基化,在GC的发生和发展中,发挥明显的调控作用。在这个过程中包含的准确基因或途径,需要进一步探索。团队的研究证实,FTO促进了GC细胞活力、集落形成、迁移和侵袭,为FTO在GC进展中的致癌作用,提供了令人信服的证据。然而,根据TCGA数据库的分析,FTO(或SP1)的表达,与胃癌的分级、分期或亚型之间,没有显著关系。此外,团队将SP1和AURKB确定为FTO的下游靶标,揭示了参与GC进展的信号转导轴。肿瘤具有独特的微环境,来控制肿瘤细胞的命运。AURKB作为FTO/SP1/AURKB通路的下游关键节点,可以影响GC的肿瘤微环境。TCGA分析显示,AURKB与基质评分呈负相关,这意味着AURKB高表达肿瘤的免疫细胞,浸润程度相对较低。免疫细胞相关性分析显示,AURKB的高表达,可导致B细胞、T细胞(CD4或CD8)、NK细胞、DC、巨噬细胞和CAFs的免疫富集降低。更重要的是,实验结果表明,GC中FTO/SP1/AURKB信号表达的增强,也可能通过调节肿瘤免疫微环境,来深入控制其恶性进展,这可能对患者的治疗和预后非常不利。团队还发现,FTO至少通过上调SP1表达和AURKB来增强GC细胞的恶性,而AURKB又通过增加ATM和P38的磷酸化来激活它们,导致P53 失活。P53是一种肿瘤抑制因子,在维持基因组稳定性和限制异常细胞增殖方面,起着重要作用。P38磷酸化并激活多种转录因子,包括P53。P38 MAPK通过调节细胞中的EMT,在肿瘤细胞侵袭和转移中起重要作用。研究表明,CLIC1通过ROS介导的P38 MAPK信号通路,调节胃癌细胞的迁移和侵袭。与两者相关的信号通路,在细胞周期的调控中,具有广泛的作用,是肿瘤治疗的研究热点。这为驱动GC发展和转移的潜在分子机制,提供了新的见解。表明FTO可能是GC治疗的潜在靶点。靶向FTO活性或表达,可以通过破坏致癌信号轴,来抑制肿瘤生长和转移。团队的工作还为开发FTO特异性抑制剂,作为GC治疗的新型疗法,奠定了基础。
然而,团队的研究,主要依靠体外实验和异种移植小鼠模型,来研究FTO在GC中的功能。虽然为GC进展,提供了有价值的细胞和分子见解,但这些方法,可能无法完全概括人体中发生的复杂肿瘤微环境和相互作用。因此,在更具临床相关性的模型中,这些将是有益的。例如,患者来源的异种移植物或类器官培养物,这些模型更忠实地反映了人类GC的异质性和复杂性。
总之,团队目前的工作,为FTO在GC进展中的作用,提供了全面的证据。团队阐明了FTO通过调节SP1-AURKB-ATM轴,来促进细胞增殖和转移。研究结果强调了FTO、SP1、AURKB和ATM,作为GC治疗的预后生物标志物和治疗靶点的潜力。这项研究拓宽了科学界对GC发展的分子过程的理解,并为开发创新的诊断工具和靶向治疗奠定了基础。虽然团队将SP1-AURKB-ATM轴确定为FTO调控的主要下游通路,但不能排除FTO也靶向其他信号通路,以促进GC进展的可能性。进一步探索替代的下游途径和相关的细胞过程,将使科学界能够正确理解FTO在GC开发中的作用。